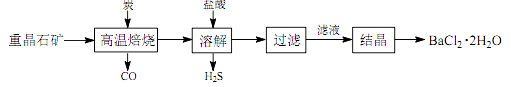
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
途径 2:以毒重石(主要成分 BaCO3 , 含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
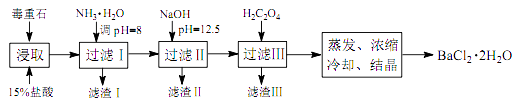
已知: Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
准确称取 mg BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为。