反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g)△H1=+125kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)=C3H6(g)+H2O(g)△H2=-118kJ·mol-1
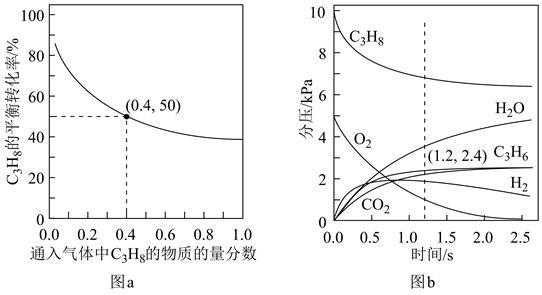
反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为,其理由是。