|
物质 |
H2(g) |
C(石墨,s) |
C6H6(l) |
|
燃烧热△H(kJ•mol-1) |
-285.8 |
-393.5 |
-3267.5 |
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1 , 当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于kPa。
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O
=CO2+CO
Ⅲ. Ⅳ.CO +2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为。
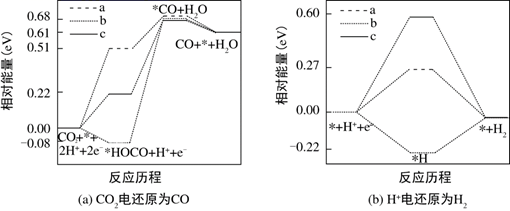
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为(用a、b、c字母排序)。
微信扫码预览、分享更方便