I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
|
CO2(mol) |
H2(mol) |
CH3OH(mol) |
H2O(mol) |
|
|
反应a(恒温恒容) |
1 |
3 |
0 |
0 |
|
反应b(绝热恒容) |
0 |
0 |
1 |
1 |
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2 , 分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
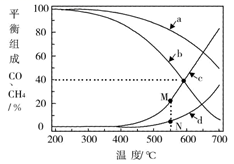
1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是和。M点平衡组成含量高于N点的原因是。
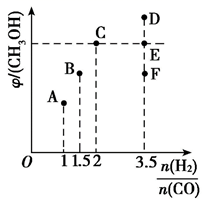
当 时,达到平衡后,CH3OH的体积分数可能是图像中的(填“D”、“E”或“F”)点。