I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
和少量CaSO4 .
①电解MnSO4溶液的离子方程式是
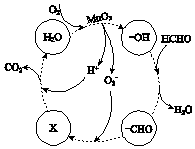
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是,总反应的化学方程式是.