2Fe+3Br2═2FeBr3 , 2FeBr3 2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
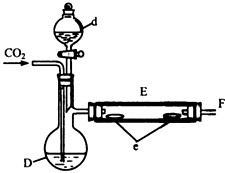
请回答:
A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
实验操作 | 实验现象 | 氧化性强弱 |
① | 溶液呈血红色 | ② |
③ | ④ | Cl2>Br2 |