请回答下列相关问题:
2NO3-(aq)+10e-+12H+(aq)=N2(g)+6H2O(I)△H
反硝化过程实际分多步进行(全过程电子均来自作电子供体的同种有机物),其中的三步反应为:
NO3-(aq)+2e-+3H+(aq)==HNO2(aq)+H2O(I) △H1
HNO2(aq)+e-+H+(aq)=NO(g)+H2O(I) △H2
N2O(g)+2e-+2H+(aq)=N2(g)+H2O(I) △H3
则另一步反应2NO(g)+2e-+2H+(aq)=N2O(g)+H2O(Ⅰ)的反应热△H4=(用含△H、△H1、△H2、△H3的代数式表示)。水体中发生反硝化作用可减弱硝酸积累对水中生物的危害,但土壤中过多发生反硝化作用对农业生产不利,原因是 。
A.溶液的pH不再改变
B.NH4+的消耗速率和H+的生成速率相等
C.溶液中氮原子的总物质的量保持不变
D.断开3molO=O键的同时消耗2molH2O
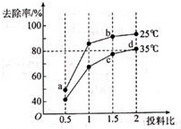
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时,反应速率迅速下降的原因可能是。