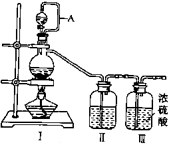
①写出利用装置Ⅰ制备氯气的离子反应方程式:。
② 利用上述装置制备NO时,Ⅱ中盛装物质为(写化学式)。

①装置连接顺序为a→按气流自左向右方向,用小写字母表示)。
②为使NO和Cl2恰好完全反应生成CNO,理论上通入NO和Cl2 , 两种气体的流速比为。
③装置Ⅸ的作用是。
④装置吸收尾气,有同学认为尾气中的某种气体不能完金被吸收。为了充分吸收尾气,可将尾气与(气体)同时通入NaON溶液中。
⑤王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2 , 该反应的化学方程式为。
⑥写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中,。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)