|
物质的名称 |
俗名 |
化学式 |
类别 |
|
|
A |
碳酸钠 |
纯碱、 苏打 |
NaCO3 |
盐 |
|
B |
碳酸钙 |
生石灰 |
CaCO3 |
盐 |
|
C |
氢氧化钙 |
熟石灰 |
CaO |
金属氧化物 |
|
D |
氢氧化钠 |
苛性钠、烧碱 |
NaOH |
碱 |

 B .
B .  C .
C .  D .
D . 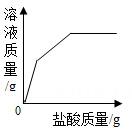


在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到现象时,证明了盐酸和NaOH溶液发生了化学反应。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氧氧化钠和盐酸发生了反应。但有的同学不赞同,他认为仍利用此装置,再补充一个实验才能达成实验2目的,实验时,针筒内需要的试剂及用量为。
实验3是某酸与某碱进行的三个实验,其中硅胶具有吸水性,吸水后由蓝色变红色。若酸与碱能反应,你能预测的实验现象是:。

【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是(填字母)。
A酸 B碱 C盐
【作出猜想】
①可能是Na2CO3溶液;
②可能是NaCl溶液;
③请你再作出一种猜想,猜想的物质与上面类别不同:可能是溶液。
【设计并实验】
实验 | 实验操作 | 实验现象 | 实验结论和解释 |
Ⅰ | 取样于试管中,向其中滴加几滴无色酚酞试液。 | 无色溶液变红 | 该溶液不可能是NaCl溶液。 理由。 |
Ⅱ | 另取样于另一只试管中,向其中滴加足量的稀盐酸。 | 产生大量的气泡 | 该溶液溶质为碳酸钠。 |
由此,同学们得出结论:该溶液是碳酸钠溶液。
老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量的溶液,若观察到红色溶液不褪色现象,即可说明该溶液中有氢氧化钠。

实验1:用pH试纸测试滤液pH,其中pH约为1。
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。能说明硫酸有剩余的是。(选填“实验1”或“实验2”)

【查阅资料】
①NaOH与CuSO4反应会生成Cu(OH)2 , 也会生成Cu4(OH)6SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO。
③Cu4(OH)6SO4不溶于水,能与酸反应,分解温度需300℃。
猜想一:浅绿色固体为Cu(OH)2
猜想二:浅绿色固体为。
猜想三:浅绿色固体为Cu(OH)2和Cu4(OH)6SO4固体
①取少量浅绿色固体放入试管中,加热至100℃,观察到有黑色固体物质,说明浅绿色固体中存在。
②另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,该白色沉淀是。
