实验一:鉴定否含碳酸钙
分别取真假珍珠粉适量于两支试管中,加入一定量的稀盐酸,并将产生的气体通入中,发现都变浑浊,说明真假珍珠粉都含有碳酸钙。
实验二:鉴定是否含蛋白质
提供的器材有:相同的燃烧匙2个,酒精灯1个,火柴。小红通过实验,得出:假珍珠粉不含蛋白质。请试着写出小红的实验方案:。
①溶质为硝酸锌和硝酸铜 ②溶质为。
①剖开新鲜洗净的猪小肠,露出内层黏膜并剪成长度相等的两段,分别放入甲、乙培养皿中;
②向甲培养皿中的小肠黏膜滴加 , 向乙培养皿中的小肠黏膜滴加15mL新鲜菠萝汁;
③把甲、乙培养皿放在37℃恒温条件下,10分钟后用放大镜观察黏膜的变化情况。

根据实验设计,回答下列问题:
假设1:迷走神经受电流刺激后,电流信号造成心脏跳动减慢;
假设2:迷走神经受电流刺激后,分泌某种物质使心脏跳动减慢。
在老师的指导下,他们设计如图装置实验进行了探究。
实验步骤:
①取甲、乙两个正常跳动的蛙心脏,用插管把它们连接起来,剪去蛙心脏乙的迷走神经;
②向蛙心脏甲中注人液体X(能维持蛙心跳动但不影响跳动频率),并流动起来,使两蛙心脏中充满液体X,测量两个蛙心的心率;
③ ▲ , 再次测量两个蛙心的心率。

请回答下列问题:

|
试管号 |
GA溶液(mL) |
水(mL) |
缓冲液(mL) |
种子20个 |
实验步骤 |
实验结果 |
|
|
步骤1 |
步骤2 |
||||||
|
1 |
0 |
1 |
1 |
带胚 |
25℃保温24小时后去除种子,在各试管中分别加入1mL淀粉液 |
25℃保温10分钟后各试管中分别加入1mL碘液,混匀后观察溶液颜色 |
++ |
|
2 |
0 |
1 |
1 |
去胚 |
++++ |
||
|
3 |
0.2 |
0.8 |
1 |
去胚 |
++ |
||
|
4 |
0.4 |
0.6 |
1 |
去胚 |
+ |
||
|
5 |
0.4 |
0.6 |
1 |
不加种子 |
++++ |
||
说明:淀粉液遇碘液变蓝色(淀粉被分解得越彻底,遇碘液颜色越浅):实验结果中“+”越多表示颜色越沫。
回答下列问题:
点左侧光滑,右侧粗糙。将物体M从O点压缩弹簧到P点,然后由静止释放,当物体M运动到O点与弹簧分开,最终运动到Q点静止。

请补充完成他们的探究过程:
[查阅资料]①金属镁能与热水反应生成氢氧化镁和氢气:Mg+2H2O=H2↑+Mg(OH)2↓;
②氯化铵能与氢氧化镁反应:2NH4Cl+Mg(OH)=MgCl2+2NH3↑+2H2O;
③浓硫酸能吸收氨气,且不产生其他气体。
[建立猜想]镁与水反应的速度可能与反应的温度有关。
[实验过程]按照下图装置进行实验
小明在实验装置中,分别加入等量的镁粉和蒸馏水,改变反应物温度,在反应过程中添加氯化铵溶液,测量收集50mL氢气所用时间,绘制图像如图乙所示。


该小组同学为了测定氢氧化铜样品中氢氧化铜的含量(杂质不参加反应),按照如图装置进行实验。已知:氢氧化铜样品的质量为m1g,E中药品足量,F中集气瓶足够大,完全反应后测得C中剩余固体质量为m2g,E中质量增加m3g。
他猜想可能是以某个角度射出时箭矢运动的距离最远。为了验证自己的猜想,小科在教室里找到了一个带指针的大量角器(指针可以绕 A 点转动,方便指示角度)、原长为 7cm 的橡皮筋和一些粉笔头,并把橡皮筋的一端固定在指针上,如图乙所示。
猜想一:生成物中除铜离子外可能还有其它离子;
猜想二:可能与铜离子浓度偏大有关;
|
溶液浓度 |
溶液很浓 |
溶液较浓 |
溶液很稀 |
|
溶液颜色 |
黄色 |
绿色 |
蓝色 |
实验材料用具:小白鼠30只、葛根膳食纤维、蒸馏水,血糖测定仪等。
实验步骤:①随机选取10只小白鼠作为甲组,另外20只制备成实验性糖尿病小白鼠随机均分成乙组和丙组。
② , 并进行数据统计,记入表格。
③甲组和乙组小白鼠每天灌喂5mL蒸馏水,丙组小白鼠灌喂 , 连续灌喂17天。(期间各组小鼠均饲喂普通饲料,自由饮食。)
④17天后,测定各组小白鼠的空腹状态下血糖浓度,数据记录如下表所示:
|
组别 |
开始实验时(毫克/升) |
17天后(毫克/升) |
|
甲 |
914 |
910 |
|
乙 |
3234 |
3139 |
|
丙 |
3247 |
1182 |
[查阅资料]
①常温下镁粉能与水反应放热而铁粉不能。
②氢氧化镁是难溶于水的白色固体。
[进行实验]
同学们用如图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:

(实验时的室温为22.7℃;除B外,其余实验中镁粉的质量均为1.0g)
| 实验序号 | A | B | C | D | E | F |
| 固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
| 乙中现象 | 少量肥皂泡难以点燃 | 无肥皂泡 | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡点燃有爆鸣声 |
| 混合物温度 | 23.1 ℃ | 22.8℃ | 23.1 ℃ | 24.2℃ | 22.8℃ | 27.2℃ |
①使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入。
②实验A证明了镁粉与水能反应,反应的化学方程式为。
①同学们分析实验数据发现,升高的温度不足以加热食物,其可能的原因是。
②同学们根据实验结果进一步猜测:实验F中的反应结束后,甲中的固液混合物中仍然含有NaCl和铁粉。应通过实验证明了上述猜测,实验方案是:取少量固液混合物,,得到白色固体(经检验为NaCl)。

【实验操作】取一块状石灰石于试管中,往试管中加入5毫升稀盐酸。
【实验现象】①开始时固体表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液无色。
【初步分析】⑴反应停止后,某同学根据上述实验现象进行初步判断,得出了石灰石没有反应完的结论。支持该同学得出这一结论的依据是(填上述实验现象的序号)。
【小组讨论】大家讨论后认为,要判断是否恰好完全反应,可以从液体和固体两条途径进行探究:一是探究残留液体中是否还有盐酸;二是探究残留块状固体中是否还有碳酸钙。
【继续探究】⑵对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论,小金的理由是 ;
⑶探究残留块状固体中是否还有碳酸钙。小丽取原残留块状固体用水洗净后加入稀盐酸,将产生的气体通入澄清石灰水,出现了的现象,于是得出残留块状固体中还存在碳酸钙。
【实验结论】在原反应结束时,稀盐酸与石灰石没有恰好完全反应,石灰石中碳酸钙有剩余。

|
故障现象 |
检测结果 |
故障原因 |
|
|
取下小灯泡,两表的指针位不变 |
小灯泡断路 |
⑴上述实验中发生的化学反应有:
①CaO+H2O=Ca(OH)2; ②Ca(OH)2+Na2CO3=2NaOH+CaCO3↓。
⑵在探究固体A的成分时,小科同学通过分析提出了二个假设
假设一:固体A中只有CaCO3
假设二:固体A中含有CaCO3和Ca(OH) 2;含有Ca(OH) 2的理由是。
在验证假设过程中,小科取少量固体A于试管中加入足量水,振荡、静置,向上层清液中滴硫酸铜溶液,出现现象,假设二成立。
⑶在探究溶液B中的溶质成分时,小科同学通过对化学反应的分析又提出了三个假设
假设一:溶液B中的溶质是NaOH;
假设二:溶液B中的溶质是NaOH和Na2CO3;
假设三:溶液B中的溶质是NaOH和。
①请在假设三中补上另一种物质。
②在验证假设过程中,小科取出部分溶液B并向其中加入了足量的稀盐酸,小科这一实验操作的目的是为了验证哪一个假设?并说明理由。

【探究一】小金设计了图甲所示的实验,他每次控制小球在斜面的同一高度自由静止释放,在水平面上第一次铺上毛巾,第二次铺上棉布,第三次铺上玻璃,观察A球在水平面上运动距离的远近。
小华“控制质量不同的小球从斜面上同一高度由静止开始滑下”的目的是。

|
次数 |
电压U/v |
电流I/A |
实际功率P/W |
电阻R/Q |
|
1 |
1.6 |
0.20 |
0.32 |
8.00 |
|
2 |
2.0 |
0.22 |
0.44 |
9.09 |
|
3 |
2.5 |
0.24 |
0.60 |
10.42 |
小金观察到灯L1的亮度变化是:第二次比第一次亮,第三次比第二次更亮。
结合表中数据得出的结论是;
|
实验序号 |
乒乓球的硬度 |
下落高度H/米 |
反弹高度h/米 |
|
1 |
大 |
1 |
0.67 |
|
2 |
2 |
1.33 |
|
|
3 |
3 |
2 |
|
|
4 |
小 |
1 |
0.4 |
|
5 |
2 |
0.8 |
|
|
6 |
3 |
1.2 |

可供选择的药品及器材:溶质质量分数为9.8%的稀硫酸、薄铁片、量筒、剪刀、秒表、天平、温度计、酒精灯等;
老师对实验的建议:①为减少反应放热对溶液温度的影响,每组实验铁片的质量取0.5克。
②铁片放人布袋内;
③实验至少设计3组;
④实验中采用水浴加热的方式控制反应的温度;
①检查装置气密性;
……

[查阅资料]
Ⅰ.碱石灰是氢氧化钠与氧化钙的固体混合物。
Ⅱ.无水硫酸铜是一种白色固体,遇水会变成蓝色。
[提出问题]该固体中Na2CO3的质量分数是多少?
[反应原理]碳酸钠与稀硫酸反应会生成CO2 , 反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
[制定计划]同学们设计了实验方案(装置气密性良好,浓硫酸、碱石灰均足量)。
方案:用图1所示装置测定反应生成CO2的质量。称取一定质量的样品于锥形瓶中,通入一段时间空气后,向样品中滴加稀硫酸,待样品反应完全,继续通入一段时间空气后,测出生成CO2的质量,计算。

[分析与讨论]
⑴方案中,浓硫酸的作用是。
⑵小科同学认为原方案的装置设计还存在一个明显缺陷,可增加图2中的一个装置进行改进,改进后整套装置的连接顺序为(按气流方向填写装置序号)。

[进行实验]同学们在完善实验方案后,测出了该NaOH固体中Na2CO3的质量分数。
[反思与评价]实验后,有同学提出,还可以用“沉淀法”进行测定:称取一定质量的样品放入试管中,加水溶解,加入过量X物质,充分反应后,过滤,将滤渣洗涤、干燥、称量,计算可得固体中Na2CO3的质量分数。则X物质可以是下列中的(选填字母代号)
A.KCl溶液
B.MgCl2溶液
C.Ba(NO3)2溶液
D.Ca(OH)2溶液

|
实验 |
步骤与操作 |
实验现象 |
结论 |
|
实验一 |
1.取2个相同的塑料瓶,分别集满二氧化碳,编号A、B组. |
两瓶内气体无色透明,瓶子形状正常。 |
氢氧化钠和二氧化碳发生了反应 |
|
2.分别向A、B两瓶中加入等量的氢氧化钠溶液和清水,立即拧紧瓶盖并振荡。 |
? |
||
|
实验二方案 |
先向反应前氢氧化钠溶液中滴加酚酞,充分通入二氧化碳后观察洛液颜色变化,比较前后的颜色,得出结论 |
||


|
注射器A |
注射器B |
|
|
甲组 |
1体积分数的H2O2溶液5mL |
2%项量分数的酵母菌液2mL |
|
乙组 |
1体积分数的H2O2溶液5mL |
蒸馏水2mL |
①选用2套图甲装置分别设置甲组与乙组,并将表中所示液体吸入相应注射器中;
②将装置恒温10分钟后,观察并记录各活塞对应的刻度变化量;
③打开止水夹,将注射器A中的液体缓慢推至B中后再夹紧止水夹,恒温5分钟后,观察井记录注射器B活塞对应的刻度变化量,重复试验3次并取平均值;
④改变实验温度(温度设置:0℃、10℃、20℃、30℃、40℃、50℃、60℃),重复步骤①②③步骤。在不同温度下,步骤②中活塞对应的刻度变化量均为0,步骤③中甲组和乙组的注射器B活塞对应的刻度变化量随温度的变化如图乙所示。


取长度为9厘米,宽度为5毫米,中间窄度不同的锡纸条搭在一节5号干电池的正负极,
实验现象如下表:
|
中间部分窄度/mm |
1 |
2 |
3 |
4 |
5 |
|
现象 |
少量火星、狭窄处迅速裂断 |
狭窄处被 点燃 |
狭窄处出现大量火星,不断裂 |
狭窄处出现少量火星、不断裂 |
狭窄处无 火星 |
请回答下列问题:

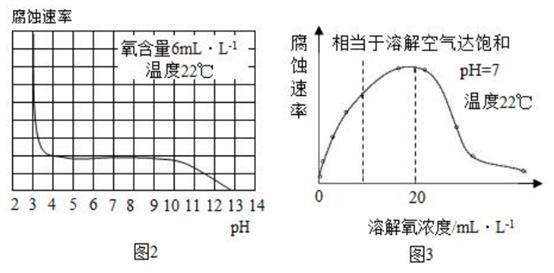
①图2表示水样温度22℃、氧含量6mL/L时,钢铁腐蚀速率与水样pH的关系。当pH<4时,随pH值减小,钢铁腐蚀速率明显增大的原因是。
②图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超20mL/L时,钢铁腐蚀速率明显下降的原因可能是。