化石燃料主要包括煤、石油和,煤的燃烧过程中能转化为热能。
a.氢能 b.木炭 c.太阳能 d.秸秆
《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明铜锡合金相较于铜、锡的特点是。

装置B中仪器甲的名称是。

“管道疏通剂”包装袋上相关信息如图。
查阅资料:铝和氢氧化钠固体遇水反应放出大量的热,能加快氢氧化钠对毛发等淤积物的腐蚀,同时产生的气体能增加管道内的气压,利于疏通。该反应的化学方程式为:。(注:NaAlO2名称为偏铝酸钠,溶液显碱性,)
小夏取少量该疏通剂加入适量水,充分反应后,无固体残留,说明疏通剂中一定已完全反应。取少量反应后溶液,向其中滴入1滴酚酞试液,可观察到溶液呈色。
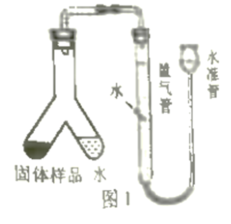
小文设计了图1装置测定该疏通剂样品中铝粉的质量分数。将300mg固体样品和足量水分别放在Y形管两侧,倾斜Y形管,将水倒入左侧:充分反应后,冷却到室温,利用量气管和水准管测定反应生成的氢气体积为100mL。已知该条件下氢气密度为0.09mg/mL。请计算样品中铝粉的质量分数。(写出计算过程)。