①大米、玉米、薯类中主要富含的营养素是(填字母序号)。
A.蛋白质 B.油脂 C.糖类 D.维生素
②抓三农促振兴,坚定建设农业强市。2022年,我市规划大豆种植须达到53.5万亩。正所谓:“庄稼一枝花,全靠肥当家”。大豆等农作物生长期间常需施加一些肥料。下列属于复合肥料的是(填字母序号)。
A.CO(NH2)2 B.NH4H2PO4 C.K2SO4
A 增加适量NaCl B.减少适量NaCl
C.增加砝码 D.调节天平平衡螺母

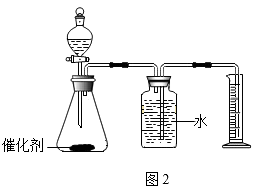
①制取H2S气体的发生装置可选用(填字母序号)。
②若用C装置来收集H2S,气体应从端(填a或b)进入集气瓶。
实验序号 | 过氧化氢溶液 | 催化剂 | 收集50mLO2所用时间 |
实验1 | 30mL2% | 粉末状MnO2 0.2g | 21s |
实验2 | 30mL2% | 粉末状CuO ag | 47s |
①表格中a的值为。
②实验1中制取氧气的化学反应方程式为。
③结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是。
【查阅资料】碱石灰的主要成分是CaO和NaOH。
【设计与实验】
方案甲:“气体质量法”

①按上图所示连接好装置,检查装置气密性后加入一定质量的碳酸钠样品于装置A中。
②打开止水夹K通入一段时间的氮气后,称量装置C的质量,并记录。
③关闭止水夹K,打开分液漏斗活塞向A装置中注入足量的稀硫酸,关闭活塞。
④待装置A中无气泡产生后打开止水夹K,再次通入氮气一段时间后,关闭止水夹K,第二次称量装置C的质量,并记录。
⑤计算。
①装置A中发生反应的化学方程式为。
②装置B中浓硫酸的作用是。
③步骤(4)中再次通入氮气的目的是。
④装置D的作用是。
方案乙:“沉淀质量法”

写出上述流程中相关反应的化学方程式:。
同学们经过实验,最终都计算出了样品中碳酸钠的质量分数。
请你根据方案乙中测定的相关数据,求出样品中碳酸钠的质量分数为×100%(用含有m、n的代数式表示)。
同学们经过讨论认为方案乙优于方案甲,理由主要是____(填字母序号)。