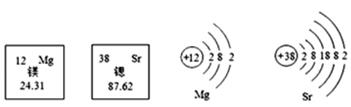
卢瑟福用a粒子(α粒子是带两个单位正电荷的氦原子核)轰击金箔的实验,推翻了汤姆生在1903年提出的原子结构模型,为建立现代原子理论打下了基础,但通过该实验的下述三种现象(如图),不能获得核外电子带有负电荷的结论。
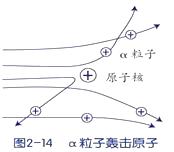
现象1:大多数α粒子能穿透金箔而不改变原来运动方向。
现象2:一小部分α粒子改变原来的运动方向。
现象3:极少数α粒子被弹了回来。
①现象1的原因:
②现象2的原因:
请回答下列问题:
[查阅资料]成人每天食用食盐的质量通常为6 g,
某种加碘食盐的标签如图所示。

[问题分析]500 g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
[结论]日常服用加碘食盐(填“能”或“不能”)起到避免核辐射的目的,原因是。