
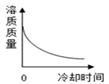
 B .
B . 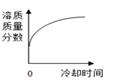 C .
C . 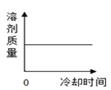 D .
D . 
海洋中蕴含丰富的资源.
(1)海水淡化是解决淡水资源不足的重要方法.下列方法中,可以使海水变为淡水的是 (填字母序号).
A.滤纸过滤 B.吸附 C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和热传热介质.重水中重氢原子(D)的相对原子质量是2,则重水中氢元素的质量分数为 .
(3)从海水中制备纯碱和金属镁的流程如图所示:

回答下列问题:
①步骤Ⅴ中所加试剂是 .
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下了物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为 (填字序号).
a.适量的盐酸 b.稍过量的Na2CO3溶液 c.稍过量的Ba(OH)2溶液
③第Ⅲ步反应的化学方程式是 .
④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点是(写一条).
(1)自然界中的水几乎都属于 (混合物/纯净物).
(2)有时我们在野外可以看见清澈的山泉水,泉水虽清澈,它也不能直接饮用,因为有可能是硬水,我们可用进行鉴别,在生活中,可用的方法来降低水的硬度.
(3)对于“既浑浊又恶臭”的脏水,我们也可将其变成纯净物.其步骤主要有:
①静置沉淀,②加明矾,③ ,④吸附,⑤蒸馏,这一系列净化处理后,将其变为较纯净的水.
在步骤②中,加入明矾的作用是: .
在步骤③中,会用到的仪器有、烧杯、 、玻璃棒,这其中,玻璃棒的作用是 ;若经过操作③后,所得液体中仍有浑浊,其原因可能是 ;(填写字母)
a.滤纸没有紧贴漏斗内壁
b.漏斗下端未靠在烧杯内壁
c.漏斗内液面高于滤纸边缘.
溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
Ⅰ.上表中的两种物质在40℃时,的溶解度较大;请用相应的数据列式表示该温度时KNO3饱和溶液的质量分数 (不要求计算).
Ⅱ.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 .
Ⅲ.20℃时,将20g NaCl放入50g水中,所得溶液的质量是 g.
Ⅳ.从NaCl溶液中得到NaCl晶体的方法是 .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).

所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 .

①40℃时,将50g硫酸镁加入100g水中,充分搅拌,所得溶液的溶质质量分数为(结果精确到0.1%)。若使其形成饱和溶液,可采取的措施有。
A.增加溶质 B.蒸发溶剂
C.升高温度 D.降低温度
②关于卤水中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)三种物质,下列说法正确的是。
A.三种物质均为易溶物质
B.10℃时,向40g氯化钾(KCl)固体和40g氯化镁(MgCl2)固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
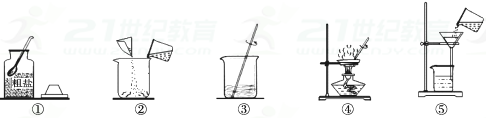
a.实验操作有错误的步骤是;
b.步骤③中玻璃棒的作用是;
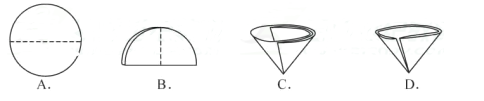
实验四:操作⑤中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。
 图甲
图甲 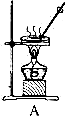
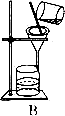
![]() 图乙
图乙
(填字母)。
a.烧杯 b.10mL 量筒 c.100mL 量筒 d.滴管 e.玻璃棒 f.药匙
①称量食盐时,砝码放左盘食盐放右盘 ②将称好的食盐倒入烧杯时,有食盐洒落烧杯外
③用量筒量取水时仰视读数 ④将量好的水倒入烧杯时,有少量水溅出

A.食盐没有全部溶解即过滤 B.过滤后滤液仍然浑浊就蒸发结晶
C.蒸发后,所得精盐很潮湿 D.称量最终的产品时,器皿上沾有的精盐没全部转移到天平上
通过晾晒海水或煮井盐水、盐湖水等,可以蒸发除去水分,得到粗盐,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).通过如图所示过程,使粗盐得到初步提纯:
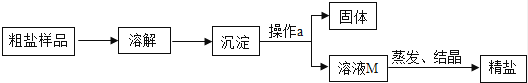
实验步骤 | 实验现象 | 实验结论 |
取一定量精盐样品于试管中,加水使之完全溶解,并向其中加入 ① | ② | 写出一个相应的化学方程式:③ 结论:该精盐样品为混合物 |

a.粗盐提纯实验的操作顺序为(填上述操作序号次序);
b.经操作⑥后滤液仍浑浊,原因可能是(答出一点即可);
c.④步骤中的玻璃棒有作用。
a、计算:可计算出需精盐克,需水毫升。
b.称量和量取:称量氯化钠时,若发现天平指针向左偏,则应怎么处理?。
C.溶解:经检测,所配制的氯化钠溶液的溶质质量分数偏小,其可能原因是。
A.所用的氯化钠固体中含有杂质
B.量取水时,仰视读数
C.将水倒入烧杯时,有少量水溅出
D.将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
E.将配制好的溶液转移进试剂瓶时,有溶液洒落
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
硝酸钾 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 |
氯化钠 | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
温度/℃ | 60 | 70 | 80 | 90 | 100 | |
硝酸钾 | 110 | 138 | 169 | 202 | 246 | |
氯化钠 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.剩余溶液一定是硝酸钾饱和溶液
Ⅱ.剩余溶液一定是氯化钠不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有硝酸钾
利用海水提取粗盐的过程如图所示,回答有关问题.
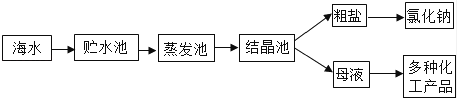
①配制时,涉及以下实验步骤:A.称量及量取 B.计算 C.溶解 D.装瓶贴标签.其正确的实验步骤顺序是 (填字母).
②将已配好的100g质量分数的6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是 g(计算结果精确到0.1).