 B . 导线铜丝
B . 导线铜丝  C . 烧菜铁锅
C . 烧菜铁锅  D . 玻璃茶壶
D . 玻璃茶壶 


共享电动车使用铅酸电池作为能源,正极的主要成分是二氧化铅(PbO2),负极为铅(Pb)。
猜想①:样品成分是 Ca(OH)2 ;
猜想②:样品成分是 Ca(OH)2 和 CaCO3 ;
猜想③:样品成分是 。
小红设计实验并根据现象得出相应结论:
|
实验 |
实验步骤 |
实验现象 |
实验结论 |
|
1 |
取熟石灰样品放入烧杯中,加水溶解,过滤; |
分离出滤液,滤纸上残留白色固体 |
样品中有 CaCO3 |
|
2 |
向滤液中加入适量无色酚酞溶液 |
溶液变红色 |
样品中有 Ca(OH)2 |
小红得出结论:熟石灰样品的主要成分 Ca(OH)2 和 CaCO3 。

Ⅰ 取一根塑料管,沿中间轴均匀地切成两个半凹型的塑料管;
Ⅱ 将两根半凹型的塑料管连接起来,如图所示;
Ⅲ 塑料管外壁标上刻度;
Ⅳ 将一颗钢珠从管口静止释放,观察并记录钢珠推动木块的距离。
|
组别 |
1 |
2 |
3 |
4 |
5 |
|
小球质量/克 |
2 |
5 |
5 |
5 |
20 |
|
小球下滑高度/厘米 |
10 |
10 |
20 |
30 |
5 |
|
木块移动距离/厘米 |
4 |
10 |
20 |
30 |
? |
根据表中数据,推测第 5 组时,纸盒移动的距离应为厘米。

① 木炭和氧化铜按 1:6、1:8、1:10、1:12、1:14 的质量比进行配制。
② 将木炭和氧化铜放入研钵中充分研磨 10 分钟并烘干,冷却后充分混合。
③ 连接装置,加入混合物,加热。待反应结束,冷却后倒出混合物,观察并记录混合物状态。
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 反应物质量 比(C:CuO) | 1:6 | 1:8 | 1:10 | 1:12 | 1:14 |
| 实验现象 | 轻微红热 | 红热 | 红热 | 红热 | 轻微红热 |
| 物理状态 | 红色金属光泽固体中有较多黑色固体 | 红色金属光泽固体中有少量黑色固体 | 大量红色金属光泽固体 | 砖红色粉末中有少量红色金属光泽固体 | 砖红色粉末中有少量黑色固体 |
【实验器材及药品】厚度相同的铝片和铬片(表面打磨过)、质量分数为 10%的稀盐酸、剪刀、秒表、注射器若干、具支试管若干、橡胶塞若干、相同气球若干。
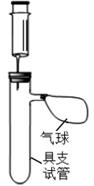
( ( 温馨提示:在金属活动性强弱差别不大时,产生气泡的快慢 难以区分) )。
建议:①每组实验中取用稀盐酸 10mL;②每组实验取用金属片 2 片;。

|
实验次数 |
1 |
2 |
3 |
4 |
5 |
6 |
|
样品质量/g |
30 |
30 |
30 |
30 |
30 |
30 |
|
稀硫酸质量/g |
50 |
100 |
150 |
200 |
250 |
300 |
|
生成气体质量/g |
0 |
0.1 |
0.3 |
0.5 |
a |
0.6 |
(Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4==Fe2(SO4)3+3H2O)

(Na2CO3+2HCl=2NaCl+H2O+CO2↑,BaCl2+Na2CO3= BaCO3↓+2NaCl)