实验一:相同条件下,将10.00g下列物质分别置于相同规格的烧杯中,敞口放置在空气中,烧杯中物质质量随时间变化如下表。
| 时间 | 水 | 饱和石灰水 | 稀盐酸 | 浓硫酸 | 氢氧化钠溶液 |
| n小时 | 8.14g | 8.32g | 8.62g | 11.16g | 9.36g |
| 2n小时 | 5.74g | 5.93g | 6.67g | 12.53g | 8.45g |
实验二: 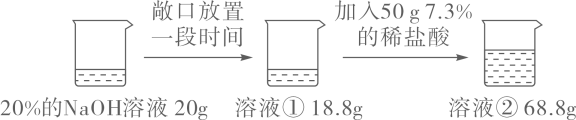
下列说法错误的是( )

|
燃料(气态) |
CO |
H2 |
CH4 |
|
热量(KJ) |
282.6 |
285.8 |
890.3 |
①从等体积燃料完全燃烧放出的热量分析,最适合家庭使用的燃料是;
②CO与其它燃料相比的主要缺点是。
③有科学家提出:“硅是未来的石油”,硅能在O2中燃烧生成SiO2 , 并放出大量的热。与化石燃料相比,用硅作燃料的优点是(写一点即可);SiO2的化学性质与CO2有相似性,也能与NaOH溶液反应,该反应的化学方程式为。
①下列溶液用水作溶剂的是(填字母序号);
a.生理盐水 b.碘酒 c.葡萄糖溶液
②将100g溶质质量分数为98%的浓硫酸稀释为溶质质量分数为10%的稀硫酸,需加水的质量为g。
③如图为某物质在水中的溶解度曲线,欲使a点所示溶液变为b点,可采取的措施是。

④20℃时,用精密仪器称量5.85gNaCl和7.90gNH4HCO3 , 放入盛有50.00g水的烧杯中,充分搅拌,静置,有晶体析出。请结合下表分析,理论上析出的晶体及晶体的质量分别为。20℃时,五种物质在水中的溶解度如下表:
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
| 溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |

(资料)①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
a.锌44t 铜76t 750℃
b.锌38t 铜82t 500℃
c.锌55t 铜65t 190℃
d.锌25t 铜95t 750℃
(查阅资料)玉米适宜在pH为6.0~7.0的土壤中生长;植物生长需要多种营养元素,包括碳、氢、氧、氮、磷、钾、钙、镁等大量元素和其他微量元素。
(任务一)检测土壤的酸碱度并制定改良方案
可选用的实验用品:精密pH试纸(可精确到0.1)、标准比色卡、pH计、其他自选
|
实验步骤 |
测量结果 |
实验结论 |
|
步骤一:将3份不同位置的土样,干燥后分别与自来水按2:5的质量比在不同的烧杯中混合,充分搅拌后静置; |
试样一:pH=4.2 试样二:pH=4.4 试样三:pH=4.5 |
该土壤pH<6.0,不适合玉米生长 |
|
步骤二:。 |
反思与评价:该实验方法有一处不够严密,请指出并说明原因。
实验方法:取300g土样和g蒸馏水混合,向其中加入一定量熟石灰,充分搅拌后静置,用pH计测定清液的pH;
测量结果:清液的pH为12.1;
反思:若要使改良的土壤适合玉米生长,需控制加入熟石灰的量。
实验目的:研究使300g土样呈中性所需的熟石灰的质量
实验方法:。
(任务二)分析土壤肥力
通过观察,该土地上玉米叶色略有发黄,且有倒伏现象;该小组同学建议施加适量含氮元素和钾元素的复合肥,如。