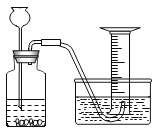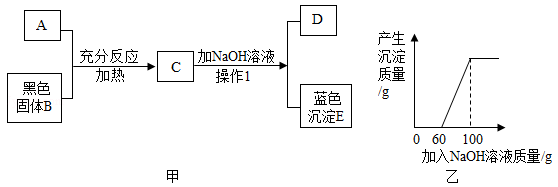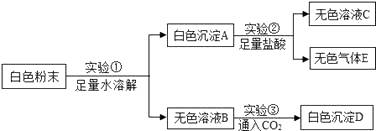
|
反应时间(秒) |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
|
|
收集到的气体体积(毫升) |
甲金属 |
25 |
60 |
95 |
130 |
160 |
170 |
170 |
|
乙金属 |
30 |
75 |
120 |
150 |
150 |
150 |
150 |
|