
解的速率,还需要进行实验②和③:在实验
②中加入稀硫酸后,无明显变化。在实验③ 中加入后,会观察到大量的气泡,证明该离子起到了催化作用。
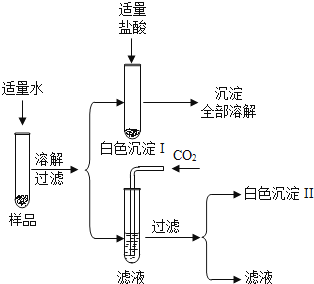
【提出问题】氢氧化钠固体是否变质?
【实验探究】甲、乙两同学分别设计了不同方案加以实验。
甲同学的方案及实验:
|
实验步骤 |
实验现象与结论 |
|
①取少量白色固体于试管中,加水振荡至全部溶解 |
无色溶液 |
|
②用pH试纸测①溶液的pH值 |
溶液的pH>7,说明氢氧化钠固体没有变质 |
乙同学的方案及实验:
|
实验步骤 |
实验现象与结论 |
|
①取少量白色固体于试管中,加水进行振荡至全部溶解 |
无色溶液 |
|
②向①溶液中加入适量氯化钡溶液 |
产生白色沉淀,说明氢氧化钠固体已变质 |
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:加入的稀硫酸是否过量?
【假设猜想】针对疑问,太家纷纷提出猜想。甲组同学的猜想:稀硫酸可能过量。
【实验探究】为了验证猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。

【得出结论】通过探究,全班同学一致确定猜想是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出实验中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:①实验操作中的错误是。②实验方案中也有一个是错误的,错误的原因是。

【原理思路】利用Na2CO 3与稀H 2SO 4反应产生CO 2 , 通过CO 2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度。
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略)。装置中,仪器A的名称。
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差(填序号)。
①加入的稀硫酸量不足 ②装置内空气中的CO 2 没有排出
③反应产生的CO 2 未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO 2 质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。图乙B装置中样品在与稀硫酸反应前和停止反应后要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是 。(填a、b、c的打开或闭合情况)
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将(填“偏高”、“偏低”或“无影响”)
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想①:Cr>Al>Cu 猜想②:Cr>Cu>Al 猜想③:Al>Cr>Cu 猜想④:Al>Cu>Cr
|
实验操作 |
实验现象 |
实验结论 |
|
室温下,将大小相同并打磨光亮的铬片、铝片、铜片分别投入盛有体积相同、溶质质量分数相同的稀硫酸的试管中。 |
铬片表面产生气泡缓慢,铝片表面产生气泡较快,铜片表面无现象 |
猜想. (填序号)成立 |
① 把甲放入乙的盐溶液中 ②把乙放入丙的盐溶液中 ③把甲放入丙的盐溶液中
你认为该方案中的 (填序号)没有必要做。

| 观察对象 | 现象 |
| ①干燥的普通铁丝 | 没有明显变化 |
| ②潮湿的普通铁丝 | 较多红褐色锈斑 |
| ③潮湿的纯铁丝 | 没有明显变化 |
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。