

【提出问题】向氯化铁溶液中滴加氢氧化钙溶液,为什么没有产生红褐色沉淀?
【作出假设】假设 1:氢氧化钙溶液变质了;
假设 2:氢氧化钙的溶解度小,溶液中氢氧根离子的浓度太小;
假设 3:氯化铁溶液呈酸性.请回答下列问题:
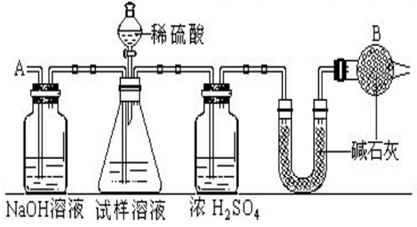
①按图示组装仪器,并检查装置的气密性.
②将 a 克试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液.
③称量盛有碱石灰的 U 形管的质量,为 b 克.
④从分液漏斗滴入硫酸溶液,直到不再产生气体时为止.
⑤反应结束后,从导管 A 处缓缓鼓入一定量空气.
⑥再次称量盛有碱石灰的 U形管的质量,为 c 克,计算出二氧化碳质量为c-b 克请填空和回答问题:
资料 1:HCl气体极易溶于水。
资料 2:过氧化氢溶液和二氧化锰可以制取氧气

