单选题
试题详情
有A、B两种金属放入等质量且等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是( )

- A、 金属活动性A>B
- B、 相对原子质量A<B
- C、 与金属A反应的硫酸一定是过量的
- D、 与金属B反应的硫酸一定是过量的
试题详情
除去下列各物质中的少量杂质,所用方法不可行的是( )
序号 | 物质 | 杂质 | 除去杂质的方法 |
A | FeSO4溶液 | CusO4 | 加入过量的锌粉,充分反应后过滤 |
B | NaCl | 泥沙 | 加水溶解、过滤、蒸发 |
C | Cu粉 | Fe粉 | 用磁铁吸出 |
D | CO2 | CO | 将混合气体通过灼热的CuO |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
金属钯(Pd)是种用于制首饰的银白色贵金属,现进行如下三个实验:由上述现象可知,钯在金属活动性顺序中位于( )
| 实验一 | 实验二 | 实验三 | |
| 实验操作 | 将钯丝伸入稀盐酸 | 将银丝伸入PdCl2溶液 | 将铂丝伸入PdCl2溶液 |
| 实验现象 | 无明显现象 | 银丝表面析出固体,溶液中出现白色沉淀 | 无明显现象 |
- A、 氢之前
- B、 银和铂之间
- C、 氢和银之间
- D、 铂之后
试题详情
在利用黄铜(一种合金)制作机器零件的过程中会产生黄铜屑,经测定黄铜屑主要含Zn、ZnO、Cu和CuO。下列分析错误的是( )
- A、 将黄铜屑加入足量稀硫酸中,会有气泡产生
- B、 将黄铜屑加入足量稀硫酸中,黄铜屑会全部溶解
- C、 根据黄铜屑的成分,可确定黄铜中含有锌和铜两种金属
- D、 根据黄铜屑与足量稀硫酸反应的现象,可比较锌和铜的金属活动性强弱
试题详情
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
- A、 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
- B、 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
- C、 “青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于物理变化
- D、 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
试题详情
某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入少量的稀盐酸,无气泡产生,则下列有关说法中正确的是( )
- A、 滤出的固体中一定含有银,滤液可能含有硝酸亚铁
- B、 滤出的固体中一定含有银和铜,一定不含有铁
- C、 滤液中一定含有硝酸亚铁,一定没有硝酸银
- D、 滤出的固体中一定含有银,滤液中一定含有硝酸亚铁
试题详情
将一定质量的Fe粉加入到Mg(NO₃)₂和Cu(NO₃)₂的混合溶液中,充分反应后过滤,得滤渣和滤液。下列说法正确的是( )
- A、 滤渣质量与加入的Fe粉质量可能相等
- B、 滤液中一定有Mg(NO₃)₂、Fe(NO₃)₂,可能有Cu(NO₃)₂
- C、 若加入的Fe粉过量,则得到的滤液呈无色
- D、 若向滤渣中加入稀盐酸,有气泡生成,则滤渣中一定有Cu、Fe、Mg
试题详情
CuCl₂是重要的化工原料。工业上常采用将Cu与稀盐酸在持续通入空气的条件下反应,FeCl₃具有催化作用,反应原理如图所示。下列说法正确的是( )

- A、 该实验说明Cu能与稀盐酸发生置换反应
- B、 参加反应的O₂、HCl分子个数比为1:4
- C、 该反应过程中需要持续添加FeCl₃溶液
- D、 该过程中只有铜、氧元素化合价发生改变
试题详情
观察、分析实验现象, 可以帮助我们理解科学的本质。下列现象描述正确的是( )
- A、 钠在氯气中燃烧, 可看到产生大量的白烟
- B、 铝箔在氧气中燃烧, 可看到淡蓝色的火焰
- C、 同时贴在曋豆叶片上下表面的氯化钴试纸,可看到上表面的试纸先变色
- D、 铁粉和硫粉混合加热后, 可得到黄色固体
试题详情
某同学在探究  三种金属的活动性顺序时, 做了如下实验: (1) 把
三种金属的活动性顺序时, 做了如下实验: (1) 把  和
和  分别加入稀硫酸中,
分别加入稀硫酸中,  表面产生大量气泡, Y 表面无明显现象; (2) 将
表面产生大量气泡, Y 表面无明显现象; (2) 将 放人
放人  的硝酸盐溶液中,
的硝酸盐溶液中,  表面有
表面有  析出。下列金属活动性由强到弱的顺序正确的是()
析出。下列金属活动性由强到弱的顺序正确的是()
- A、
- B、
- C、
- D、
试题详情
小金做了如下实验: 将 4.2 克铁粉和 4.0 克氧化铜粉末均匀混合,然后一次性投人盛有 200 克  稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生, 后阶段产生大量无色气泡, 充分反应后上层清液呈浅绿色。由此小金作出下列判断, 其中不合理的是 ( )
稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生, 后阶段产生大量无色气泡, 充分反应后上层清液呈浅绿色。由此小金作出下列判断, 其中不合理的是 ( )
- A、 “立即出现红色固体”是由于很快发生了如下转化:
- B、 “产生大量无色气泡”是由于发生了如下反应:
- C、 该实验条件下, 硫酸铜比稀硫酸更容易跟铁粉发生反应
- D、 在不同浓度的硫酸铜和稀硫酸的混合溶液中投人铁粉, 都是硫酸铜先跟铁粉反应
试题详情
如图所示, 用导线将锌片和铜片分别连接到电流表的正负极, 插入硫酸铜溶液中即可构成化学电池。下列说法错误的是( )

- A、 该装置将化学能直接转化成电能
- B、 反应后烧杯中溶液的质量变小
- C、 实验说明锌的金属活动性大于铜
- D、 涉及的反应为
试题详情
向盛有一定质量MgSO4、FeSO4和CuSO4混合溶液的烧杯中,加入锌粉至过量使其充分反应(溶液始终未饱和),烧杯中溶质、溶剂和金属的质量随锌粉质量变化情况如图所示。下列说法正确的是( )
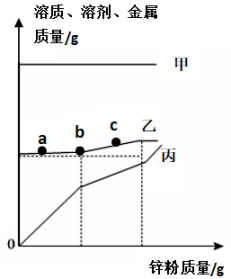
- A、 丙代表烧杯中金属的质量
- B、 bc段发生反应:Zn+CuSO4=ZnSO4+Cu
- C、 溶液的质量a>c
- D、 c点溶液一定是无色的
试题详情
将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一。仅根据下表数据判断,适宜采用上述方法制取的合金是( )
金属 | Na | Mg | Al | Cu | Fe |
熔点/℃ | 97.5 | 640 | 660 | 1083 | 1535 |
沸点/℃ | 883 | 1090 | 2467 | 2567 | 2750 |
- A、 Fe—Na合金
- B、 Al—Na合金
- C、 Mg—Fe合金
- D、 Cu—Na合金
试题详情
小明同学将一枚洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,且产生少量的气体。于是,他们重新配制硫酸铜溶液,再次实验,又观察到相同的现象,关于该实验,有如下说法:
①生成的气体可能是氢气 ②完全反应后溶液呈黄色
③实验中一定发生了置换反应 ④由实验可以得出金属活动性顺序:Cu>Fe
⑤硫酸铜溶液可能显酸性 ⑥重做实验没有任何意义
其中正确的说法是( )
- A、 ①②③
- B、 ①③⑤
- C、 ④⑤⑥
- D、 ③⑤⑥
试题详情
关于下列实验现象,描述错误的是( )
- A、 光亮的铜丝放入稀硫酸中,溶液变为蓝色,产生大量气泡
- B、 镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体
- C、 铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
- D、 氢气在空气中燃烧,产生淡蓝色火焰,放出大量的热
试题详情
三星堆考古相继出土一批青铜器等精美文物。青铜的主要成分为铜、锡(Sn)合金,若要验证铜、锡的化学活动性强弱,下列试剂不能选用的是( )
- A、 ZnSO4溶液、Cu、Sn
- B、 稀硫酸、Cu、Sn
- C、 CuSO4溶液、Sn
- D、 SnSO4溶液、Cu
填空题
试题详情
金属及金属材料在生产、生活中有广泛的应用。
试题详情
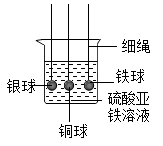
人类对科学规律的认识常需经历漫长的探索过程,对金属活动性规律的认识也是如此。
试题详情
向硝酸铜、硝酸银的混合溶液中加入一定量锌粉,充分反应后过滤,得到固体A和液体B,回答下列问题。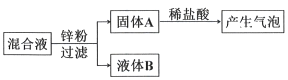

①若液体B仍呈蓝色,则B中一定含有的溶质有。
②若液体B呈无色,且向固体A中加入稀盐酸后产生气泡,则固体A中一定含有的物质有。
试题详情
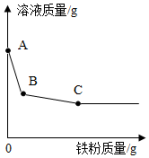
实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小金设计了如图实验方案来分离、回收废液中的金属铜和银。根据如图实验过程和现象回答问题:

实验探究题
试题详情
某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图所示(部分产物略去)

查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+、Ni2+转化为对应的氢氧化物沉淀时,溶液pH有如图关系:

试题详情
现有10g锌、8g氧化铜和足量的稀硫酸,某同学想用这些锌和氧化铜为原料来制取铜单质,他采用了如下所示的流程图和实验装置(如图1):Zn H₂
H₂ Cu
Cu

试题详情
化学与生产生活联系紧密,回答下列问题:

解答题
试题详情
金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示: