Zn2++2Fe2++3C2O+6H2O
ZnFe2(C2O4)3·6H2O↓
ZnFe2(C2O4)3·6H2O……
某兴趣小组按下列流程制备ZnFe2O4。
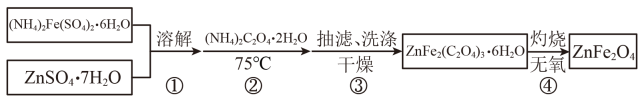
请回答:
a.烧杯 b.坩埚 c.蒸发皿 d.马弗炉 e.表面皿
完成灼烧得到产品的化学方程式是。
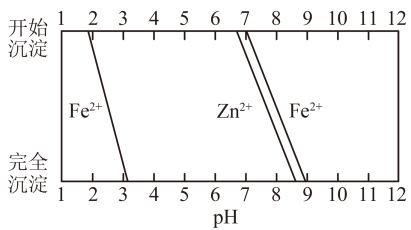
从以下选择合适步骤并填空;d→→→→i→→→e;
a.加入新制氯水;
b.锌皮完全溶于稍过量的3 mol·L-1稀硫酸;
c.加入30%H2O2;
d.锌皮用热碱洗涤干净;
e.过滤、洗涤、干燥;
f.过滤得ZnSO4溶液;
g.加入纯ZnO粉末;
h.蒸发浓缩,冷却结晶;
i.加热到60℃左右,并不断搅拌;
其中步骤i中加热的主要目的是:。