单选题( 每个4分,共4×16=64分)
试题详情
下列事实:①NaHSO4溶液呈酸性;②长期施用化肥(NH4)2SO4会使土壤酸性增强,发生板结; ③配制CuCl2液时,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤明矾净水;⑥蒸干FeCl3溶液,得不到FeCl3固体。
其中与盐类的水解有关的有( )
- A、 仅②③⑤
- B、 仅②③④⑤⑥
- C、 仅①②③④⑤⑥
- D、 仅②③④⑤
试题详情
设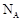 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
- A、
 的
的 溶液中,所含的
溶液中,所含的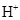 离子总数为
离子总数为
- B、
 溶液中,所含的阳离子总数大于
溶液中,所含的阳离子总数大于
- C、 一定条件下,在某一恒容密闭容器中,
 和
和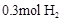 充分反应后,生成的
充分反应后,生成的 分子总数为
分子总数为
- D、
 溶液中,所含的
溶液中,所含的 分子总数为
分子总数为
试题详情
下列说法不正确的是( )
- A、 非自发的反应一定可以通过改变条件使其成为自发反应
- B、 相同物质的量的同种物质气态时熵值最大,固态时熵值最小
- C、 反应
 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的
- D、 恒温恒压下,
 且
且 的反应正向能自发进行
的反应正向能自发进行
试题详情
下列依据热化学方程式得出的结论正确的是( )
- A、 已知2SO2(g)+O2(g)⇌2SO3(g) △H<0,则SO2的能量一定高于SO3的能量
- B、 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
- C、 已知H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ·mol-1 , 则任何酸碱中和反应的热效应均为57.3 kJ
- D、 已知2C(s) +2O2(g) =2 CO2(g) △H1 ;2C(s) +O2(g) =2CO (g) △H2则△H1<△H2
试题详情
为达到相应实验目的,下列实验操作可行的是( )
| 编号 | 实验目的 | 实验操作 |
| A | 证明碳酸酸性强于硼酸 | 向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生 |
| B | 证明HClO是弱电解质 | 用pH试纸测NaClO溶液的pH值 |
| C | 除去碱式滴定管内的气泡 | 将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 |
| D | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | 向 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
下列各组离子在给定溶液中能大量共存的是( )
- A、 在醋酸溶液中:K+、NO
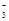 、SO
、SO
- B、 在氯化钠溶液中:I-、Fe3+、HCO
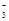
- C、 在硝酸溶液中:Cl-、Fe2+、SO

- D、 在氨水中:Cu2+、Na+、NO
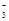 、S2-
、S2-
试题详情
Ni可活化 放出
放出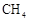 , 其反应历程如图所示。下列说法正确的是( )
, 其反应历程如图所示。下列说法正确的是( )

- A、 决速步骤:中间体1→中间体2
- B、 总反应为
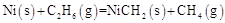
 kJ·mol
kJ·mol
- C、 涉及非极性键的断裂和生成
- D、 在此反应过程中Ni的成键数目没有发生变化
试题详情
部分弱酸的电离平衡常数如下表:
| 弱酸 |
|
|
|
|
| 电离平衡常数 |
|
|
|
|
运用上述电离常数及物质的特性判断下列化学方程式不正确的是( )
- A、 次氯酸与
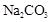 溶液的反应:
溶液的反应:
- B、 碳酸钠滴入足量甲酸溶液中:

- C、 少量
 通入
通入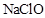 溶液中:
溶液中: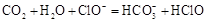
- D、 硫化氢通入
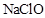 液中:
液中: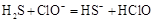
试题详情
在密闭容器中,反应2X(g)+Y2(g) 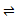 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )

- A、 图Ⅰ中,甲、乙的平衡常数分别为
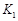 、
、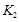 , 则
, 则
- B、 图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
- C、 图Ⅱ中,t时刻可能是增大了压强
- D、 图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
试题详情
实验室中模拟合成氨反应: N2((g)+3H2(g) 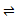 2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
2NH3(g) 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
| 实验序号 | 温度( |
| ||||||
|
|
|
|
|
|
|
| ||
| 1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
| 2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
| 3 | 200 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
下列有关说法不正确的是( )
- A、 当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态
- B、 实验2中,前
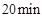 内以
内以 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为
- C、 比较实验1和2,说明实验2使用了更高效的催化剂
- D、 实验3中,
 时向容器中充入一定量
时向容器中充入一定量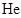 , 则正反应速率
, 则正反应速率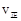 不变
不变
试题详情
常温时,下列关于电解质溶液的叙述正确的是( )
- A、 稀释pH=10的氨水,电离常数Kb减小
- B、 pH均为5的盐酸和氯化铵溶液中,水的电离程度相同
- C、 等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大
- D、 分别中和pH与体积均相同的硫酸和盐酸,硫酸消耗氢氧化钠的物质的量多
试题详情
下表是 时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( )
时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( )
| 化学式 |
|
|
|
|
|
|
|
|
|
|
- A、 常温下同浓度的①
 、②
、② 、③
、③ 溶液中,c(NH4+):①>②>③
溶液中,c(NH4+):①>②>③ - B、
 在盐酸中的
在盐酸中的 大于其在水中的
大于其在水中的
- C、 向饱和氯水中滴加
 溶液至溶液刚好呈中性时,c(Na+)=2c(ClO-)+c(HClO)
溶液至溶液刚好呈中性时,c(Na+)=2c(ClO-)+c(HClO) - D、 向浓度均为
 的
的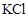 和
和 的混合溶液中滴加稀
的混合溶液中滴加稀 溶液,
溶液, 先形成沉淀
先形成沉淀
试题详情
某温度下,向10mL0.01mol/LPbCl2溶液中滴加0.01mol/L的Na2S溶液,滴加过程中lgc(Pb2+)与Na2S溶液体积的关系如图所示,下列有关说法正确的是( )
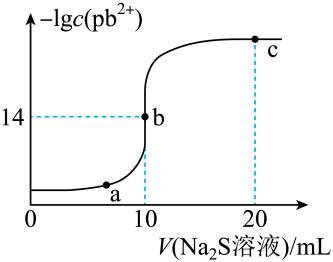
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2
- A、 a、b、c三点对应的溶液中,水的电离程度最小的为a点
- B、 Na2S溶液中:c(Na+)=c(H2S)+2c(S2-)+c(HS-)
- C、 向Zn2+、Pb2+浓度相等的混合溶液中逐滴加入一定浓度的Na2S溶液,Zn2+先沉淀
- D、 若改用0.005mol/LNa2S溶液,b点应该水平右移
试题详情
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。某污水处理厂利用微生物燃料电池处理含铬废水的工作原理如图所示。下列说法错误的是( )

- A、 电池工作时a极发生氧化反应
- B、 CH3OH与
 也可直接反应
也可直接反应 - C、 电池工作一段时间后,右边溶液的酸性增强
- D、 a极的电极反应式为

试题详情
通过甲醇羧基化法获取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)  HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( )
HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图中实线所示(图中虚线表示相同条件下CO的平衡转化率随温度的变化),下列说法不正确的是( )
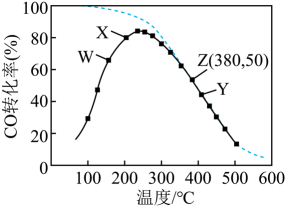
- A、 此制取甲酸甲酯的反应△H<0
- B、 图中X点,延长反应时间能提高CO转化率
- C、 图中W点,升高温度能提高CO转化率
- D、 380℃下,图中Z点,c起始(CH3OH)=5.0×10-4 mol/L,CO平衡转化率为50%,则平衡常数K(z)=2000