选择题(本题有16小题,每小题3分,共48分。请选出各小题中一个符合题意的选项,不选、多选、错选均不给分。)
- A、 甲烷的化学式为C2H4
- B、 甲烷燃烧只生成水
- C、 甲烷是天然气的主要成分
- D、 甲烷与空气的混合物,被点燃时不可能会发生爆炸
- A、 用氢氧化铝治疗胃酸过多——氢氧化铝能与盐酸发生反应
- B、 湿法炼铜——铜的金属活动性比铁强
- C、 用生石灰制作自热盒饭的发热材料——与水反应放热
- D、 用氢氧化钠吸收二氧化硫——氢氧化钠能与二氧化硫反应
- A、 氢氧化镁、硫酸铜溶液
- B、 盐酸溶液、氢氧化钡溶液
- C、 碳酸钠溶液、氯化钾溶液
- D、 硫酸溶液、氯化钠溶液
- A、 盛放过生锈铁钉后留下的红棕色固体
- B、 装氧化铜粉末后留下的黑色固体
- C、 用氯化钡试液检验硫酸后留下的白色固体
- D、 用澄清石灰水检验CO2后留下的白色固体
物质 | CoO | Co(OH)2 | CoCl2 | CoCO3 |
在水中的溶解性 | 难溶,灰绿色固体 | 难溶,粉红色固体 | 易溶,溶液呈粉红色 | 难溶,粉红色固体 |
- A、 Co能从MgCl2溶液中置换出Mg
- B、 CoO能与盐酸反应得到粉红色溶液
- C、 CoCO3能与盐酸反应生成H2
- D、 Co(OH)2可由Co与NaOH溶液反应制得
- A、 Na2CO3、MgSO4、NaCl、K2SO4
- B、 CuSO4、KCl、NaNO3、CaCl2
- C、 Na2SO4、BaCl2、NaNO3、NaOH
- D、 Na2SO4、KCl、Mg(NO3)2、AlCl3
- A、 X>Y>Z
- B、 X>Z>Y
- C、 Y>X>Z
- D、 Z>X>Y
选项 | 实验目的 | 实验操作 |
A | 鉴别NaCl溶液和Na2CO3溶液 | 取样,分别滴加CaCl2溶液 |
B | 检验稀盐酸中是否含有硫酸 | 取样,滴加少量Ba(OH)2溶液 |
C | 除去氯化钠中的碳酸钠 | 加入适量盐酸溶液 |
D | 分离CaCO3和CaO的混合物 | 加适量水,充分溶解后过滤 |
- A、 A
- B、 B
- C、 C
- D、 D

- A、 金属锌反应最先完成
- B、 金属锌的活动性最强
- C、 金属镁生成氢气质量最多
- D、 金属铁消耗稀硫酸质量最多
序号 | 实验目的 | 实验方案 |
① | 证明变质 | 取少量固体,加水溶解,滴加紫色石蕊试液。若变蓝,则说明固体未变质 |
② | 确定成分 | 取少量固体,加入足量氯化钙溶液,过滤,向滤液中滴加酚酞试液。若变红,则说明固体部分变质 |
③ | 测定纯度 | 称取ag样品与足量氯化钡溶液充分反应,将沉淀过滤,洗涤、干燥后,得到bg固体 |
④ | 除去杂质 | 取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤 |
- A、 ①②
- B、 ①③
- C、 ②③
- D、 ③④
填空题(本题有7小题16空格,每空格2分,共32分。)


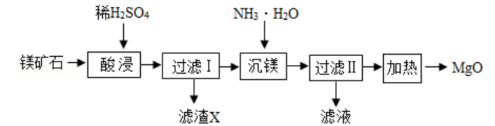
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
实验探究题(本题有5小题,第24、25、26每题各6分,第27题8分,第28题9分,共35分。)

I.常温下,空气中的氮气和稀有气体不会与镁发生反应。
II.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
为探究镁表面黑色物质的成因是与空气中的哪些成分有关,他开展如图实验进行探究。
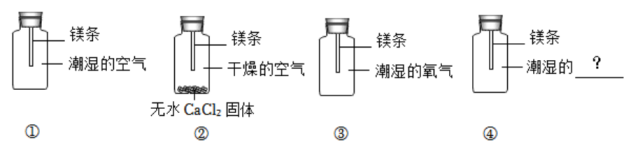
数日后第①组镁条表面出现黑色物质,第②、③组只观察到镁条表面变暗,并没有出现黑色物质。

【猜想假设】
猜想一:只含有KOH;
猜想二:含有KOH、 ;
猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
1.取溶液少许于试管中, 滴加过量稀盐酸 | 无明显现象 | 猜想二不正确 |
2.取溶液少许于试管中, 滴加少许 K2CO3 溶液 | ▲ | 猜想三正确 |
上述表格空格填空
【交流反思】
含有KOH、Ca(OH)2 的废水直接排放会造成水体污染。小组同学对废水做如图处理。C烧杯中出现 现象时,说明水中已无 KOH、Ca(OH)2。



大家对乙同学提出的质疑进行分析和验证。
解答题(本题有7小题,第29、30、31、32、33每小题各6分,第34小题8分,第35小题7分,共45分)
已知:氯化氢(HCl)是极易溶于水的无色气体,其水溶液俗称盐酸。

求:

Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1;
Ⅱ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。

请回答下列问题:
第一组 | 第二组 | 第三组 | |
反应前加入铁粉质量/g | 5.6 | 8.4 | 11.2 |
反应后剩余固体的质量/g | 3.2 | 3.2 | 6.0 |
反应后产生氢气(H2)的质量 | 0.1 | 0.2 | 0.2 |
请回答:


