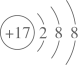单选题
试题详情
下列关于氮及其化合物的说法中不正确的是( )
- A、 氮的固定过程中一定发生了氧化还原反应
- B、 氮氧化物大量排放到空气中会造成酸雨
- C、 NO和N2都可稳定存在于空气中
- D、 N2既可作氧化剂又可作还原剂
试题详情
化学与科技、生产、生活密切相关,下列说法错误的是( )
- A、 卡塔尔AIJanoub体育场屋顶采用聚四氟乙烯板材,该板材属于有机高分子材料
- B、 大飞机C919用到了铝锂合金,铝锂合金属于金属材料
- C、 光导纤维在信息技术发展中应用广泛,制造光导纤维的主要材料是单质硅
- D、 葡萄酒中通常含有微量的SO2 , 既可以杀菌又可以防止营养成分被氧化
试题详情
已知化学反应 的能量变化如图所示,则有关说法错误的是( )
的能量变化如图所示,则有关说法错误的是( )
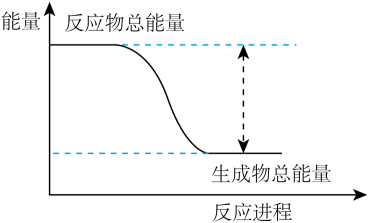
- A、 随着反应的进行,该反应向环境放出热量
- B、 A2的稳定性大于物质AB
- C、 该反应中,化学键断裂吸收的总能量小于化学键形成放出的总能量
- D、 铝片与盐酸反应的能量变化趋势与图示相似
试题详情
“绿色化学”也称作环境友好化学,其核心思想就是改变“先污染后治理”的观念和做法。下列实验或叙述中不符合“绿色化学”理念的是( )
- A、 用乙醇汽油代替普通汽油作汽车燃料
- B、 工业合成氨时,氨分离后剩余的气体再利用
- C、 制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应
- D、 通过化学方法去治理排放到环境中的废气、废渣、废液
试题详情
乙醇和乙酸是人们生活和生产中常用的有机物。下列有关说法错误的是( )
- A、 乙醇的催化氧化可以得到乙酸
- B、 1 mol乙醇可以和足量的金属钠反应产生0.5 mol H2
- C、 可用酸性高锰酸钾溶液鉴别乙醇和乙酸
- D、 可用饱和的碳酸钠溶液除去乙酸乙酯中的乙酸
试题详情
设 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
- A、 标准状况下,1 mol苯的体积为22.4 L
- B、 1 mol S在足量氧气中燃烧生成SO3的数目为
- C、 1 mol铁和过量稀硝酸反应,转移的电子数目为
- D、 30 g乙烷中含有C—H键的数目为
试题详情
煤、石油和天然气的综合利用能够提高利用率,减少污染,获得多种化工产品。下列说法错误的是( )
- A、 天然气的主要成分为CH4
- B、 通过石油裂化和裂解可获得乙烯、丙烯等重要的基本化工原料
- C、 煤的干馏和石油的分馏均属于化学变化
- D、 石油分馏后得到的汽油、煤油、柴油均是混合物
试题详情
一定量的一氧化氮和足量碳在恒容密闭容器中发生反应: , 下列不能说明反应已达平衡状态的是( )
, 下列不能说明反应已达平衡状态的是( )
- A、 NO的转化率不再发生变化
- B、 容器内压强不再发生变化
- C、 容器内混合气体的平均相对分子质量不再发生变化
- D、 容器内混合气体的密度不再发生变化
试题详情
部分含铁物质的分类与相应化合价关系如图所示。下列推断合理的是( )
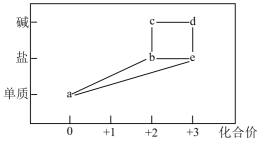
- A、 a可与e反应生成b
- B、 b只有还原性,没有氧化性
- C、 可将溶液e加入浓碱液中制得d的胶体
- D、 不可能存在b→c→d→e→b的循环转化关系
试题详情
下列实验操作能达到实验目的的是( )
选项 | 实验操作 | 实验目的 |
A | 将海带灰溶于水,过滤,向滤液中滴加淀粉溶液 | 检测海带中含有碘元素 |
B | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | 证明SO2的漂白性 |
C | 向硅酸钠溶液中通入CO2气体,有白色沉淀产生 | 验证H2CO3的酸性强于H2SiO3 |
D | 向市售乙醇中加入一小粒钠,有气泡产生 | 检测市售乙醇中存在水 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
生命活动需要一系列的复杂的化学过程来维持,食物中的营养物质是这些过程的能量基础。下列关于糖类、油脂、蛋白质的说法正确的是( )
- A、 糖类、油脂、蛋白质是人体必需的基本营养物质,在人体内都可以发生水解
- B、 向蔗糖溶液中加入稀硫酸并加热,再加入新制
悬浊液,加热,未见砖红色沉淀,则蔗糖不发生水解
- C、 油脂在酸性条件下水解的反应叫皂化反应
- D、 农业上用波尔多液(由硫酸铜溶液和石灰乳制成)来防治植物病毒的原理是重金属阳离子和强碱能使蛋白质发生变性
试题详情
下列热化学方程式书写正确的是( )
- A、 1 mol CH4(g)完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为
- B、 1 mol H2在氧气中完全燃烧放出热量为285.8 kJ,其热化学方程式为
- C、 2 mol NO2分解生成1 mol O2和2 mol NO,并吸收116.2 kJ热量,其热化学方程式为
- D、 1 mol CaCO3吸收178.2 kJ的热量完全分解,则该反应的热化学方程式为
试题详情
维生素A常作为保健药物,缓解视觉疲劳,维生素A的结构简式为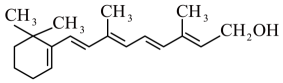 。下列有关维生素A的叙述正确的是( )
。下列有关维生素A的叙述正确的是( )
 。下列有关维生素A的叙述正确的是( )
。下列有关维生素A的叙述正确的是( )- A、 维生素A含有3种官能团
- B、 维生素A不能使溴的四氯化碳溶液褪色
- C、 1 mol维生素A最多可以和5 mol H2加成
- D、 维生素A不能和氧气发生催化氧化反应
试题详情
理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应“ ”设计了一个化学电池(如图所示)。该电池在外电路中,电流从a极流向b极。下列说法正确的是( )
”设计了一个化学电池(如图所示)。该电池在外电路中,电流从a极流向b极。下列说法正确的是( )
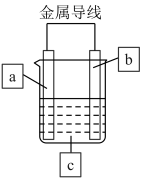
- A、 电极b的电极材料为铜,电极反应式为
- B、 电极a的电极材料可以为Ag,也可以是石墨或铁
- C、 c溶液为AgNO3溶液,放电时
向b极移动
- D、 装置放电时主要将电能转化为化学能
填空题
实验题
试题详情
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。
试题详情
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
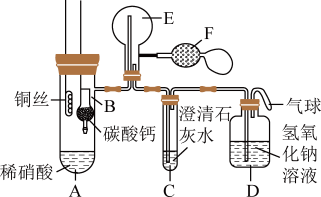
实验步骤与现象如下:
Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触,产生气体;
Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提;
Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热,A装置中产生无色气体,E装置中开始时出现浅红棕色气体;
Ⅳ.用F装置向E装置中鼓入空气,E装置中气体颜色逐渐加深;一段时间后,装置C中白色沉淀溶解。
回答下列问题:
工业流程题
试题详情
工业上常以高硫铝土矿(主要成分为Al2O3、Fe2O3 , 还含有少量FeS2等)为原料,生产Fe3O4(Fe3O4中1个Fe呈+2价,2个Fe呈+3价)和铝单质的工艺流程如图所示:
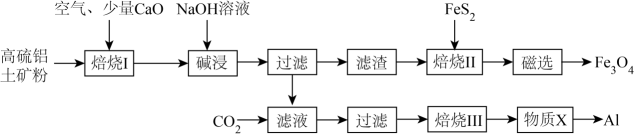
已知:①FeS2在“焙烧Ⅰ”过程中,发生反应的化学方程式为;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为
。