选择题
试题详情
同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体是否完全变质的情况。下列说法正确的是( )

- A、 甲溶液可以选择稀盐酸或BaCl2溶液(提示:BaCl2溶液显中性)
- B、 溶液B中的溶质一定只含有NaOH和甲
- C、 甲溶液的作用仅为检验Na2CO3是否存在
- D、 若Ⅱ有明显现象、Ⅲ无明显现象,则说明样品完全变质
试题详情
某氯化钾样品含有杂质氯化钙和氯化镁,设计除杂流程图如下,以下说法正确的是( )
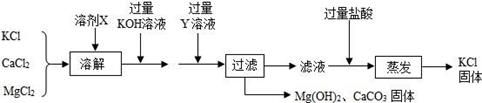
- A、 整个流程中共使用玻璃棒两次
- B、 蒸发操作是为了除去氯化钾溶液中的水
- C、 过滤前加入了过量氢氧化钾是为了除去氯化钙杂质
- D、 Y 若选用了碳酸钠,会导致最终所得氯化钾固体不纯
试题详情
现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验:

下列判断正确的是( )
- A、 无色溶液 B 的溶质是硝酸钙
- B、 原溶液中的杂质一定是氯化钙
- C、 原溶液中的杂质可能由三种物质组成
- D、 该实验中涉及的基本反应类型不止一种
试题详情
实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种。为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如图实验(此处箭头表示得出实验结论),根据实验,下列说法中不正确的是( )
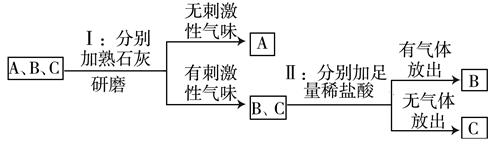
- A、 三种化肥中,尿素的含氮量最高
- B、 B物质为碳酸氢铵
- C、 常温下如要鉴别 B、C两种样品,能采取闻气味的方法
- D、 如果实验Ⅱ中B、C两种样品没有另取,则会使检验结果不准确
试题详情
现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验。下列判断正确的是( )

- A、 无色溶液B的溶质只有硝酸钙
- B、 该实验中涉及的基本反应类型不止一种
- C、 原溶液中的杂质只有氯化钙
- D、 原溶液中杂质可能由氯化钙、硝酸钙、氯化钠组成
试题详情
如图所示,已知甲是含两种或两种以上初中科学常见盐的黄色溶液,乙为NaNO3溶液。为探究甲的组成,同学们按如图所示进行了探究(每步加的试剂都是过量的)。下列推断中不正确的是( )
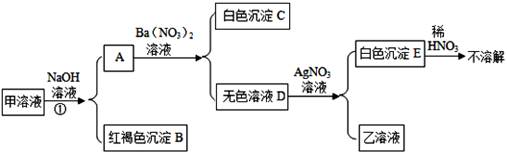
- A、 ①一定不是氧化还原反应
- B、 甲中溶质不一定是FeCl3和Na2SO4
- C、 C可能是碳酸钡
- D、 E一定是氯化银
试题详情
高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。下图为模拟制备高纯碳酸钙的主要流程,已知该大理石中杂质是二氧化硅和氧化铁。下列有关说法错误的是( )
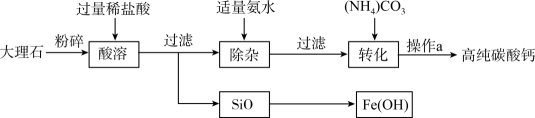
- A、 由“酸溶”可知,二氧化硅不溶于水和稀盐酸
- B、 操作a为组合操作,包含过滤、洗涤、干燥
- C、 “转化”发生的主要反应是
- D、 “除杂”中,氨水只与溶液中氯化铁反应
试题详情
取少量铁粉和硫粉混合均匀后加热。小科对产物进行如下实验(FeS+H2SO4=H2S↑+FeSO4 , H2S气体能被氢氧化钠溶液吸收,Fe3+遇硫氰化钾KSCN溶液显红色,Fe2+遇KSCN溶液不显红色)。若溶液E不显红色,则下列说法错误的是( )

- A、 刺激性气体A为SO2
- B、 黑色固体B为FeS
- C、 溶液F中的溶质为Na2S、NaOH
- D、 气体G为H2
填空题
试题详情
在道路除雪过程中,融雪剂发挥了很大的作用。某公司生产的融雪剂是由氯化钠、硝酸钾、氯化镁、硫酸铜中的二种或二种以上的物质组成的。小科为探究其成分,设计了以下实验:

请你根据以上设计过程填空;
试题详情
某工厂产生的废渣,其主要成分是碳酸钙及少量氧化铁。现用该废渣制取CaCl2晶体,其制取的流程如图所示:

浸取时,需加足量的水并连续搅拌,使反应充分。请写出浸取时与NH4Cl反应的物质(填化学式)。生成的NH3可用石蕊试纸检验。
试题详情
现有一定质量含有少量泥沙等不溶性杂质和少量氯化钙、氯化镁等可溶性杂质的粗盐样品,实验室提纯流程如图,请分析各步骤的信息作答:

试题详情
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如下图。
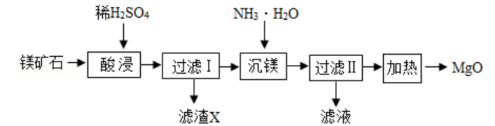
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
试题详情
某混合气体X由CO2、CO、H2O(水蒸气)、H2中的两种或两种以上组成,X气体依次通过如图1装置(假定每步反应均完全),现象分别为:A中溶液变浑浊;B中固体变为红色;C中粉末变为蓝色;D中溶液变浑浊。
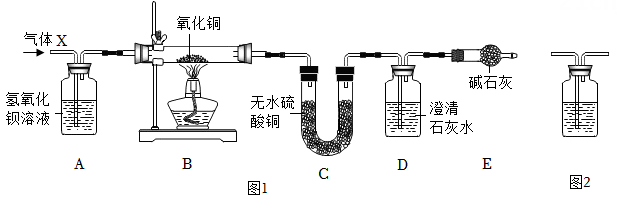

完成下列问题:
实验探究题
试题详情
利用工业碳酸钙(含少量铁、铝、钠等元素的金属矿物杂质)生产医用二水合氯化钙(CaCl2•2H2O),工艺流程如图所示。回答问题:

试题详情
菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石。小科对这种说法产生了兴趣,并进行了“菠菜里是否含有可溶性草酸盐和碳酸盐?”的探究。已知:①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。②醋酸(一种有机酸)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。探究流程如下:

根据流程回答问题:
试题详情
实验课上,同学们发现一瓶久置空气中的氧化钠固体的瓶口有白色粉末。在老师指导下,同学们对该白色粉末的成分进行了讨论。
(猜想与假设) 猜想 I:白色粉末是碳酸钠猜想 II:白色粉末是氢氧化钠
猜想 III:白色粉末是
(实验探究)取白色粉末溶于水形成溶液 A,设计如下实验:

试题详情
氯化钡是一种可溶性重金属盐,广泛应用于化工领域,其水溶液呈中性。工业上用毒重石(主要成分是 BaCO3 , 所含杂质难溶于水,不与酸反应)制备氯化钡晶体。实验小组设计了如图所示的实验室中制备氯化钡晶体的流程。


试题详情
碳酸镁是重要的无机化工产品,在医药、食品、冶金、电子等行业具有广泛的用途。实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3·3H2O。其主要实验过程如图:

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。


