选择题(本题共10小题,每小题4分,共40分,每题只有一个选项符合题意)
试题详情
化学与生活密切相关,下列说法正确的是( )
- A、 一氧化碳与血红蛋白
存在反应:
, 当
中毒时,平衡向右移动,使人体组织局部氧气浓度过高而中毒
- B、 海轮的外壳附上一些锌块,是利用了电解原理的牺牲阳极的阴极保护法
- C、 汽车尾气治理原理为:
, 由于需要借助催化转化器,因此推断该反应在常温下不能自发反应
- D、 比色分析法可用于某些化学反应速率测定,是利用有色物质浓度与溶液颜色的关系
试题详情
设 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
- A、 甲烷的摩尔燃烧焓为
甲烷完全燃烧放出
热量时,生成
个数为
- B、 氢氧燃料电池中,负极有
气体参与反应时,转移的电子数为
- C、 氯碱工业中,制备
烧碱时阴极生成气体的分子数为
- D、
和
于密闭容器中充分反应后,
分子的总数为
试题详情
飞秒化学对了解反应机理十分重要。 光分解反应
光分解反应 经过
经过 后
后 的浓度减少
的浓度减少 。下列说法正确的是( )
。下列说法正确的是( )
- A、 用
表示的反应速率是
- B、 在
时,
浓度是
浓度的2倍
- C、
末时
的反应速率是
- D、 增大
的浓度可以加快反应速率,是因为提高了单位体积内活化分子数目,活化分子百分数增多,单位时间内有效碰撞变多
试题详情
下图为工业合成氨流程图,该反应速率方程为 , 原料气(
, 原料气( 及少量
及少量 的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为:
的混合气体)在进入合成塔前可经过铜氨液净化处理,其反应为: , 有关说法错误的是( )
, 有关说法错误的是( )
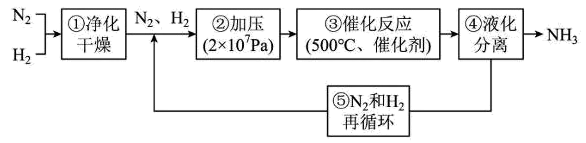
- A、 步骤①中“净化”可以防止催化剂中毒
- B、 步骤②中“加压”既可以提高合成氨原料的转化率,又可以加快反应速率
- C、 为保证足够高的反应速率,反应达到一定转化率时需及时将氨从体系中分离
- D、 “净化”时适当升高温度,可增大反应速率和
的平衡转化率
试题详情
已知 , 反应开始时,向密闭容器中加入一定量的
, 反应开始时,向密闭容器中加入一定量的 , 下列图像与描述错误的是( )
, 下列图像与描述错误的是( )
A | B | C | D |
|
|
|
|
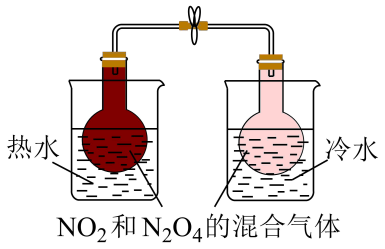
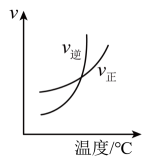
表示相同时间内体系内 | 表示体系到达平衡后, | 装置可探究温度对该化学平衡的影响,热水中颜色变深,冷水中颜色变浅 | 表示该反应正逆反应速率随温度变化图像 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列叙述错误的是( )

- A、 通电后,阴极室溶液pH增大
- B、 阳极电极反应式为2H2O-4e-===4H++O2↑
- C、 得到1 mol产品HI,阳极室溶液质量减少8 g
- D、 通电过程中,NaI的浓度逐渐减小
试题详情
科学家提出了碳酸二甲酯(结构简式为:CH3OCOOCH3)一种新的合成方案(吸附在催化剂表面上的物种用*标注),反应机理如下图所示。下列说法错误的是( )
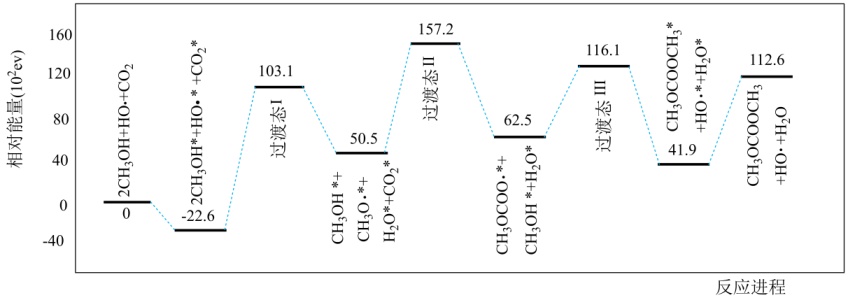
- A、 反应进程中既有O-H键的断裂,又有O-H键的形成
- B、 HO·降低了反应的活化能
- C、
是该反应的决速步骤
- D、 吸附和脱附过程中共吸收112.6eV的能量
试题详情
在一定的温度和压强下,将按一定比例混合的 和
和 通过装有催化剂的反应器可得到甲烷。
通过装有催化剂的反应器可得到甲烷。
已知:
催化剂的选择是甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测
转化率和生成
选择性[
选择性
]随温度变化的影响如图所示。下列有关说法正确的是( )

- A、 在
间,以
为催化剂,升高温度
的产率不变
- B、 延长
点的反应时间,一定能提高
的转化率
- C、 反应
在任何温度下均不能自发进行
- D、 由图像分析,工业上应选择的催化剂是
, 合适温度为
非选择题(本题共4小题,共60分)
试题详情
实验探究是学习化学原理知识的重要方法,请回答下列问题:
试题详情
实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。
试题详情
电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并将电解液和阳极泥进行回收。
试题详情
一种以钛铁矿( , 含
, 含 等杂质)为主要原料制备钛白粉
等杂质)为主要原料制备钛白粉 的工艺流程如图所示。
的工艺流程如图所示。

已知:①“酸浸”后钛元素主要以形式存在;
②在
时生成沉淀,
时沉淀完全。