选择题(本题共15小题,第1-10小题每题4分,第11-15小题每题3分,共55分。请选出一个符合题意的选项,不选、多选、错选均不给分)
- A、 具有形状记忆功能
- B、 具有很低的熔点
- C、 具有良好的延展性
- D、 具有良好的导电性
- A、 波尔多液的配制:CuSO4+Ca(OH)2══Cu(OH)2+CaSO4 中和反应
- B、 铁粉溶于稀硫酸中:2Fe+3H2SO4══Fe2(SO4)3+3H2↑ 置换反应
- C、 用氯酸钾和二氧化锰制氧气:2KClO3
2KCl+3O2↑ 分解反应
- D、 铁屑与硫粉混合加热:Fe+S══Fe2S3 化合反应
- A、 在pH=1的溶液中:NaCl Na2SO4 Na2CO3
- B、 在pH=2的溶液中:KCl Na2SO4 HNO3
- C、 在pH=13的溶液中:BaCl2 Na2CO3 NaOH
- D、 在pH=14的溶液中:FeCl3 NH4NO3 CaCl2
- A、 太阳能、氢能将是未来发展的主要能源
- B、 新型材料将在航空航天领域中得到广泛应用
- C、 塑料制品的广泛应用“有百利而无一害”
- D、 用乙醇汽油作为汽车的燃料,可节省石油资源,减少汽车尾气的污染
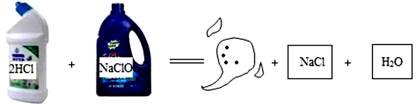
- A、 该反应属于分解反应
- B、 反应物和生成物中,属于氧化物的有2种
- C、 生成的有毒气体是Cl2
- D、 生成的有毒气体是ClO
- A、 2HI+Cl2=2HCl+I2
- B、 NH4HCO3
H2O+CO2↑+NH3↑
- C、 CO2+C
2CO
- D、 2HCl+CuO=CuCl2+H2O
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
- A、 HCl、BaCl2、Na2CO3、H2SO4
- B、 Na2CO3、BaCl2、H2SO4、HCl
- C、 H2SO4、HCl、Na2CO3、BaCl2
- D、 HCl、H2SO4、BaCl2、Na2CO3
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | C | CuO | 加入足量稀硫酸,过滤、洗涤、干燥 |
| B | NaCl | Na2CO3 | 加入足量稀硫酸,蒸发结晶 |
| C | CO2 | CO | 通过氢氧化钠溶液 |
| D | MnO2 | KCl | 加水溶解、过滤、蒸发 |
- A、 A
- B、 B
- C、 C
- D、 D
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | m | 20 | 20 |
| 反应后质量/g | 2 | 待测 | 32 | 26 |
在上述反应过程中,下列描述正确的是( )
- A、 该反应中甲、丙、丁的质量比为1︰16︰13
- B、 乙在该反应中一定是催化剂
- C、 待测质量一定为4g
- D、 该反应是分解反应
- A、 盐酸
- B、 碳酸钠
- C、 硫酸钠
- D、 氯化钠
- A、
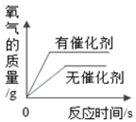 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气
用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气 - B、
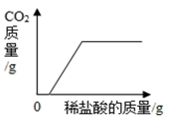 向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸
向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸 - C、
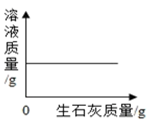 一定温度时,向一定量的饱和石灰水中加入生石灰
一定温度时,向一定量的饱和石灰水中加入生石灰 - D、
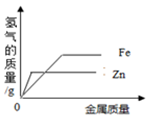 向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe
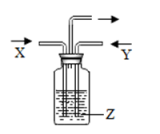
| X | Y | Z | |
| A | H2 | N2 | 水 |
| B | HCl | CO2 | 石灰水 |
| C | CO2 | O2 | 烧碱溶液 |
| D | HCl | O2 | 硝酸银溶液 |
- A、 A
- B、 B
- C、 C
- D、 D
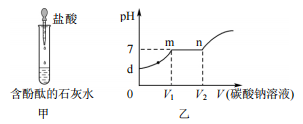
- A、 图甲中仪器的使用操作无误
- B、 图乙中 d~m 段反应过程中有沉淀产生
- C、 图乙中 m~n 段反应过程中溶液质量变小
- D、 图乙中 n 点之后溶液中的溶质有 Na2CO3 和 NaCl
填空题(本题共7小题,每空2分,共36分)
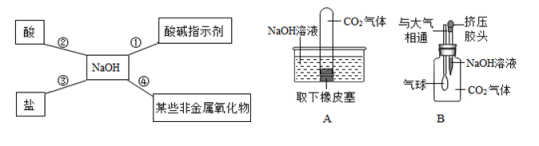
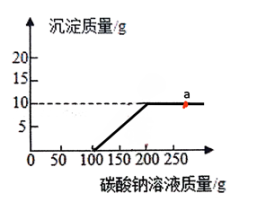
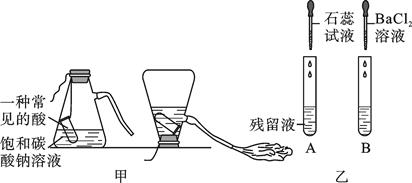
为验证性质④,他选择了二氧化碳与其反应,为探究两者是否发生了化学反应,小李设计了如图所示的A、B实验进行验证。实验现象为:A中试管内液面上升,B中。李莉提出质疑,她认为A实验不严谨,应做一个对比实验:。
实验探究题(本题共4小题,每空3分,共39分)
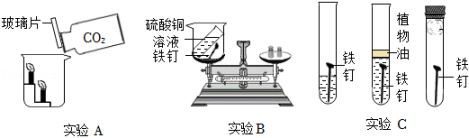
【建立猜想】①两种酸溶液的pH不同.(注:pH相同,则单位体积溶液中H+数目相同)
②两种酸溶液中的不同.
【实验过程】
| 实验次数 | 试剂 | 实验条件 | 实验现象 |
| 1 | 0.2gCuO粉末+6mLpH=0的盐酸 | 常温 | 黑色粉末溶解,溶液呈蓝绿色 |
| 2 | 0.2gCuO粉末+6mLpH=0的硫酸 | 常温 | 无明显现象 |
| 3 | 0.2gCuO粉末+6mLpH=0的硫酸+0.35gNaCl | 常温 | 黑色粉末溶解.溶液呈蓝绿色 |
| 4 | 0.2gCuO粉末+6mLpH=0的硫酸+0.35g | 常温 | 无明显现象 |
【实验结论】常温下,pH相同的盐酸和硫酸溶液于CuO反应现象出现差异的原因是由于促进了反应的进行.
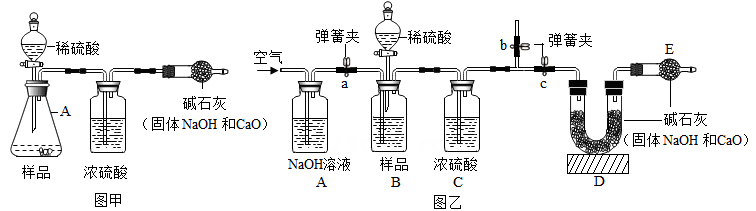
【原理思路】利用碳酸钠与稀硫酸反应产生CO2 , 通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算烧碱样品纯度。
解答题(本题共7小题,第27、28、29、30小题各6分,第31、33小题各8分,第32小题10分,共50分)

请回答下列有关问题:
| 成分:氢氧化钠固体、铝粉 |
| 净含量: 200克 |
| 注意事项:使用时要防明火 |
| 保存方法:密封 |
| 使用范围:毛发残渣等淤积物 |
将过量的稀盐酸加入20g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱将液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | X | 6.6 |