单选题
试题详情
下列说法错误的是( )
- A、 可逆反应的ΔH 表示完全反应时的热量变化,与反应是否可逆无关
- B、 放热反应不需加热就能反应,吸热反应不加热就不能反应
- C、 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH 相同
- D、 已知:①C(s,石墨)+O2(g) =CO2(g) ΔH1=-393.5kJ∙mol−1 ②C(s,金刚石)+O2(g) =CO2(g) ΔH2=-395.0kJ∙mol−1 , 则石墨比金刚石稳定
试题详情
在下列溶液中,pH 由大到小的排列顺序是( )
① 0.1 mol·L-1 KOH 溶液 ② 0.1 mol·L-1 CH3COOH 溶液 ③ 0.1 mol·L-1 HNO3溶液 ④ 0.1 mol·L-1 H2SO4溶液
- A、 ①②③④
- B、 ②①④③
- C、 ④③②①
- D、 ③④①②
试题详情
下列事实能用勒夏特列原理解释的是( )
- A、 在FeSO4溶液中加入铁粉以防氧化
- B、 加入催化剂能使 H2O2的分解速率加快
- C、 H2、I2、HI 平衡时的混合气体加压后颜色变深
- D、 用排饱和食盐水收集 Cl2
试题详情
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)  Z(g)+W(s) ΔH>0, 下列叙述正确的是( )
Z(g)+W(s) ΔH>0, 下列叙述正确的是( )
- A、 加入少量 W,逆反应速率增大
- B、 升高温度,正反应和逆反应速率都增大
- C、 在容器中加入氦气,压强增大,反应速率增大
- D、 将容器的体积压缩,可增大活化分子的百分数,有效碰撞次数增大
试题详情
醋酸溶液中存在电离平衡:CH3COOH  H++CH3COO- , 下列叙述错误的是( )
H++CH3COO- , 下列叙述错误的是( )
- A、 升高温度,醋酸的电离常数 Ka增大
- B、 0.10 mol·L-1的 CH3COOH 溶液加水稀释,溶液中导电粒子的数目增大
- C、 CH3COOH 溶液中加少量的 CH3COONa 固体,平衡逆向移动
- D、 25℃时,欲使醋酸溶液的 pH、电离常数 Ka和电离程度都减小,可加入少量冰醋酸
试题详情
恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g)  2SO3(g),下列不能用来判断该反应达到平衡状态的是( )
2SO3(g),下列不能用来判断该反应达到平衡状态的是( )
- A、 容器中压强不再变化
- B、 SO2的体积分数不再变化
- C、 容器中混合物的密度不再变化
- D、 容器中各物质的浓度不再变化
试题详情
下列有关电化学在生产、生活中的应用分析正确的是( )
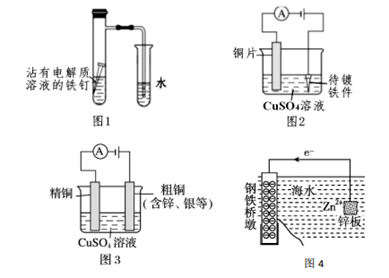
- A、 图 1:导气管口有气泡冒出
- B、 图 2:铁件上能发生的反应是:
- C、 图 3:溶液中c(Cu2+)增大
- D、 图 4:采用了牺牲阳极的阴极保护法保护桥墩
试题详情
纯的叠氮酸(HN3)是一种弱酸,常温下用 0.2 mol·L-1HN3 溶液滴入 25mL0.1 mol·L-1NaOH 溶液中,滴加过程中的pH 值的变化曲线(溶液混合时的体积变化忽略不计) 如图。下列说法正确的是( )

- A、 该滴定过程用甲基橙作指示剂
- B、 点 B 对应溶液中:
- C、 点 D 对应溶液中:
- D、 沿曲线 A→B→C 的过程中,由水电离产生的 c(OH-)逐渐减少
试题详情
下列有关滴定的说法正确的是( )
- A、 用 25mL 滴定管进行中和滴定时,用去标准液的体积为 21.7mL
- B、 用未知浓度的 HCl 溶液滴定已知浓度的 NaOH 溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
- C、 用标准的 KOH 溶液滴定未知浓度的 HCl 溶液,配制标准溶液的固体 KOH 中混有NaOH 杂质,则结果偏高
- D、 将 KMnO4标准溶液加入碱式滴定管中,滴定未知浓度的 H2C2O4溶液
试题详情
下列实验方案不能达到相应目的的是( )
| A | B | C | D | |
| 目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
| 实验方案 | | | | |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
某课题组利用碳氨液[(NH4)2CO3、NH3·H2O)]从辉铜矿石(主要成分 Cu2S)中直接浸取铜并制取铜盐,其过程如下图所示。

其反应机理如下:
① (快反应)
② (慢反应)
③ (快反应)
下列说法正确的是( )
- A、 通入热的空气可以加快铜的浸出率,温度越高,浸出率越大
- B、 浸出装置发生的反应中,热空气的作用是氧化剂,
是还原产物
- C、 在浸出装置中加入适量的(NH4)2S2O8 , 使平衡①、②正向移动,铜的浸出率增大
- D、 提高铜的浸出率的关键因素是提高反应②的速率,原因是反应②的活化能比反应①、③的小
试题详情
下列说法正确的是( )
- A、 pH=1 的醋酸加水稀释到原体积的 1000 倍,稀释后 pH=4
- B、 某温度下,某溶液中水电离出的 c(H+)=1×10-7 mol·L-1 , 则该温度下溶液呈中性
- C、 室温下pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
- D、 其它条件相同时,同浓度同体积的CH3COOH 溶液和盐酸分别与镁反应,CH3COOH溶液反应放出气体的速率较慢
试题详情
有关①100 mL 0.1 mol·L-1 的 Na2CO3 溶液两种溶液、②100 mL 0.1 mol·L-1 的 NaHCO3 溶液的叙述错误的是( )
- A、 ①溶液中:
- B、 ②溶液中:
- C、 溶液中水电离出的 H+个数:①>②
- D、 溶液中阴离子的物质的量浓度之和:①>②
综合题
试题详情
氮的单质及其化合物在工业生产中用途广泛,请回答下列问题:
试题详情
根据化学平衡理论,请回答下列几个问题:
试题详情
电解法转化 CO2可实现 CO2资源化利用。电解 CO2制甲酸(HCOOH)的原理示意图如下:(已知 HCOOH 中 C 的化合价为+2 价)

请回答:
试题详情
利用催化技术将汽车尾气中的NO和CO进行处理,其反应方程式为: 2NO+2CO  2CO2+N2 , 为研究如何增大该反应的速率和提高转化率的问题,某研究小组在其他条件相同的条件下,使用同种、等量的催化剂进行了以下三组实验探究:实验数据记录如下表;实验中 CO 的浓度与时间的变化关系如下图(已知催化剂的比表面积是指单位质量的物质所具有的总面积)。
2CO2+N2 , 为研究如何增大该反应的速率和提高转化率的问题,某研究小组在其他条件相同的条件下,使用同种、等量的催化剂进行了以下三组实验探究:实验数据记录如下表;实验中 CO 的浓度与时间的变化关系如下图(已知催化剂的比表面积是指单位质量的物质所具有的总面积)。
| 编号 | t/℃ | c(NO)/mol·L-1 | c(CO)/mol·L-1 | 催化剂的比表面积/(m2·g-1) |
| Ⅰ | 360 | 6.5×10-3 | a | 80.0 |
| Ⅱ | 280 | b | 4.00×10-3 | 120 |
| Ⅲ | 280 | 6.5×10-3 | 4.00×10-3 | 80.0 |







