选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
试题详情
泱泱中华,历史何其悠久,文明何其博大。文物筑牢文明之基,国务院设立每年6月的第二个星期六为文化和自然遗产日,国家文物局将今年的活动主题定为“保护文物传承文明”。下列文物的材质属于天然有机高分子的是( )
|
|
|
|
A.铜奔马 | B.汉竹简 | C.莲花形玻璃托盏 | D.垂鳞纹秦公铜鼎 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
有机物在日常生活中有广泛的用途。下列有关有机物的说法错误的是( )
- A、 氯乙烷可以用来镇痛和局部麻醉
- B、 聚乙炔可用于制备导电高分子材料
- C、 苯甲酸钠可用作食品防腐剂
- D、 聚氯乙烯可用作食品包装材料
试题详情
不能正确表示其反应的离子方程式是( )
- A、 铜在氨水中被腐蚀:2Cu+O2+8NH3·H2O=2[Cu(NH3)4]2++4OH- +6H2O
- B、 泡沫灭火器的原理:Al3+ +3
=Al(OH)3↓+3CO2↑
- C、 CuSO4溶液遇到闪锌矿(ZnS)转变为铜蓝:Cu2+(aq)+ZnS(s)
CuS(s)+Zn2+(aq)
- D、 利用覆铜板制作印刷电路板:Fe3++Cu=Cu2++Fe
试题详情
下列说法不正确的是( )
- A、 熔点:石墨>金刚石>氯化钠>钠
- B、 基态原子未成对电子数:B<C<O<N
- C、 等离子体含有自由运动的带电粒子,具有良好的导电性
- D、 臭氧在四氯化碳中的溶解度高于在水中的溶解度
试题详情
NA为阿伏加德罗常数的值,下列叙述正确的是( )
- A、 常温常压下,12 g金刚石含有4NA个共价键
- B、 pH=1的乙酸和盐酸混合溶液含0.1NA个H+
- C、 标准状态下,20 g ND3含有的质子数为10NA
- D、 0.5mol异丁烯分子中,π键的数目为5.5NA
试题详情
对伞花烃(a)常用作染料、医药、香料的中间体,a可转化为b(如图)。下列说法错误的是( )

- A、 常温下对伞花烃呈液态且难溶于水
- B、 b物质的一氯代物有5种(不考虑立体异构)
- C、 对伞花烃分子中最多有9个碳原子共平面
- D、 图中氢化反应既是加成反应也是还原反应
试题详情
H2O(l)、NH3(l)均可自耦电离:2H2O(l) OH-+ H3O+、2NH3(l)
OH-+ H3O+、2NH3(l)
 +
+ 。
。
下列反应与![]() →CH3CH2OH+HBr原理不同的是( )
→CH3CH2OH+HBr原理不同的是( )
- A、 CaC2+2H2O→Ca(OH)2+CH≡CH↑
- B、 SiCl4+8NH3(l)=Si(NH2)4 +4NH4Cl
- C、 3Cl2 + 8NH3=6NH4Cl+N2
- D、 PCl3+3H2O=H3PO3+ 3HCl
试题详情
2022年的诺贝尔化学奖成果“点击化学”,成功把药物分子的合成难度大大降低,为人类带来了伟大的效益。我国科学家在寻找“点击反应”的砌块过程中,发现了一种新的化合物,其结构简式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素。下列说法正确的是.( )

- A、 X、Y、Z第一电离能最大的为X
- B、 X、Y、Z和W电负性最大的为W
- C、 X、Z、W氧化物对应的水化物均为强酸
- D、 简单离子半径:W>Z>Y>X
试题详情
下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是( )
- A、 石灰乳中存在沉淀溶解平衡
- B、 氯气与强碱反应时既是氧化剂又是还原剂
- C、 铜锌原电池工作时,正极和负极同时发生反应
- D、 Cl、Br、I的非金属性随其核外电子层数增多而减弱
试题详情
物质结构决定物质性质。下列性质差异与结构因素匹配错误的是( )
选项 | 性质差异 | 结构因素 |
A | 沸点:正戊烷(36.1℃)高于新戊烷(9.5℃) | 分子间作用力 |
B | 熔点:AlF3(1 040℃)远高于AlCl3(178℃升华) | 晶体类型 |
C | 酸性: HCOOH(pKa=3.75)>CH3COOH(pKa=4.76) | 甲基推电子效应 |
D | 碱性:Mg(OH)2大于Al(OH)3 | 第一电离能 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
某晶体立方晶胞如图。已知图中微粒1的分数坐标是(0, ,
,  ),阿伏加德罗常数的值为NA。下列说法正确的是( )
),阿伏加德罗常数的值为NA。下列说法正确的是( )
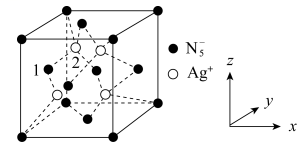
- A、 Ag+周围距离最近且相等的
个数是6
- B、 微粒2的分数坐标是(
,
,
)
- C、 已知银与铜位于同一族,银位于元素周期表的d区
- D、 若晶胞边长为apm,则相邻Ag+之间的最短距离为
a pm
试题详情
气态PH3的一种工业制法流程如图:

已知:①NA为阿伏加德罗常数的值;
②25℃时,次磷酸(H3PO2)的电离常数Ka=1.0×10-2。
下列说法错误的是( )
- A、 液态次磷酸分解反应为熵增过程
- B、 P4是非极性分子,键角为109°28'
- C、 白磷与浓NaOH溶液反应生成11.2 L PH3(标准状况下)时,转移电子的数目为1.5 NA
- D、 常温下,1 LpH=10的NaH2PO2溶液中由水电离出的c(OH-)=1.0×10-4 mol/L
非选择题:本题共4大题,共55分。
试题详情
FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等,实验室可用无水四氯化锡(SnCl4)制作FTO,制备SnCl4的装置如图所示。
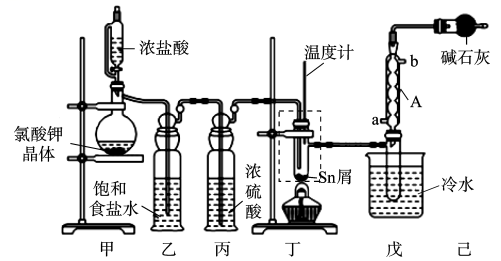
已知:①SnCl4熔点为-33 ℃,沸点为114.1 ℃,在潮湿空气中极易水解(水解生成SnO2·xH2O),且熔融Sn与Cl2反应生成SnCl4时放出大量的热。
②Sn熔点为232℃,沸点为2260℃;无水SnCl2熔点为246℃,沸点为652℃,Sn2+易被Fe2+、I2等氧化为Sn2+。
试题详情
氨基乙酸铜被广泛应用于染料、涂料、塑料和电池等领域,其化学式为(H2N-CH2-COO)2Cu,结构如图所示。

试题详情
工业上利用废镍催化剂(主要成分为NiO,还含有一定量的ZnO、Fe2O3、SiO2、CaO等)制备一水合氢氧化氧镍(2NiOOH·H2O)的工艺流程如下:

相关金属离子[c0(Mn+)=0.1 mol/L]开始形成氢氧化物沉淀的pH如下(当c(M+)≤10-5mol/L,可以认为Mn+沉淀完全):
金属离子 | Ca2+ | Zn2+ | Ni2+ | Fe3+ |
开始沉淀时的pH | 10.6 | 7.6 | 7.1 | 1.5 |
回答下列问题:
试题详情
化合物M是一种具有茉莉花香味的无色油状液体,结构简式是 , 其合成路线如下(部分反应条件未注明):
, 其合成路线如下(部分反应条件未注明):









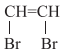 二溴乙烯
二溴乙烯 1,2,5-三甲苯
1,2,5-三甲苯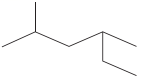 2-甲基-4 -乙基戊烷
2-甲基-4 -乙基戊烷




