单选题
试题详情
2022年北京冬奥会已经成功落下帷幕,安全、绿色、高效、智能给世界人民留下了深刻印象。下列相关说法不正确的是( )

- A、 速滑馆跨临界直接制冰使用的CO2分子属于非极性分子
- B、 冬奥会机器人所用芯片的主要成分单晶硅属于共价晶体
- C、 滑冰场上的冰(H2O)融化过程中,密度随温度升高而增大
- D、 闭幕式鸟巢上空绽放的璀璨焰火与原子核外电子跃迁有关
试题详情
徐光宪在《分子共和国》一书中介绍了许多明星分子,如O3、CO2、Cl2、CH3COOH等。下列说法不正确的是( )
- A、 Cl2分子中,Cl-Cl键是p-pσ键
- B、 酸性:甲酸<乙酸<丙酸
- C、 干冰晶体采用分子密堆积,每个CO2周围紧邻12个CO2
- D、 O3极性微弱,在CCl4中的溶解度高于在水中的溶解度
试题详情
杂化轨道理论可以用来解释分子的空间结构,下列有关该理论的说法正确的是( )
- A、 杂化轨道能用来形成σ键和π键
- B、 原子轨道杂化前后轨道总数不变,但轨道电子云轮廓图发生了改变
- C、 空间结构为V形的分子,其中心原子一定采取sp2杂化轨道成键
- D、 sp杂化轨道是由能量相同的1个s轨道和1个p轨道混合形成的
试题详情
科学家用48Ca原子轰击镕的一种同位素原子产生了一种超重元素Ts,其反应可表示为 Ca+
Ca+ Bk→
Bk→ Ts+3
Ts+3 n,下列说法不正确的是( )
n,下列说法不正确的是( )
- A、 上述反应中共有4种核素
- B、 钙原子核内中子数为28
- C、 Ts位于周期表中的p区
- D、 元素Ts所在的周期共有32种元素
试题详情
氢键的存在对生命的繁衍具有重要意义。下列物质的结构或者性质与氢键无关的是( )
- A、 乙醇可与水以任意比例互溶
- B、 S单质难溶于水,却易溶于CS2
- C、 邻羟基苯甲醛(
 )的熔点低于对羟基苯甲醛(
)的熔点低于对羟基苯甲醛( )的熔点
)的熔点 - D、 可燃冰(CH4·8H2O)中水分子笼的形成
试题详情
结合元素周期律,根据下列事实所得推测合理的是( )
选项 | 事实 | 推测 |
A | CO2是分子晶体,熔点较低 | SiO2是分子晶体,但熔点高于CO2 |
B | 根据“对角线规则”,元素Be和Al的化学性质相似 | Be(OH)2具有两性,可与稀氨水反应 |
C | 电解CuCl2溶液可得到金属Cu | 电解MgCl2溶液可得到金属Mg |
D | 三氟乙酸的酸性强于三氯乙酸的酸性 | 三氯乙酸酸性强于三溴乙酸酸性 |
- A、 A
- B、 B
- C、 C
- D、 D
试题详情
由键能数据大小,不能解释下列事实的是( )
化学键 | N≡N | O=O | F-F | H-F | H-Cl | H-Br | H-I |
键能/kJ•mol-1 | 946 | 497.3 | 157 | 568 | 431.8 | 366 | 298.7 |
- A、 熔沸点:HF>HCl>HBr
- B、 稳定性:HCl>HBr>HI
- C、 与H2的反应能力:F2>O2>N2
- D、 热分解温度:HCl>HBr>HI
试题详情
阿斯巴甜作为甜味剂被广泛应用于糖果、饮料等食品行业,该有机物的结构简式如图所示。已知当碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,则下列说法不正确的是( )

- A、 该分子含有2个手性碳原子
- B、 该分子存在手性异构体
- C、 该化合物与石墨的晶体类型相同
- D、 可通过红外光谱法确定该化合物中的官能团
试题详情
砷是氮族元素,下列有关黄砷As4(结构如图: )的叙述正确的是( )
)的叙述正确的是( )
 )的叙述正确的是( )
)的叙述正确的是( )- A、 黄砷晶体为共价键三维骨架结构
- B、 7.5g黄砷含有0.4NA个σ键
- C、 该结构中共价键的键角约为109°28′
- D、 熔点:白磷<黄砷
试题详情
已知五种短周期元素的相关信息如表,则下列有关判断正确的是( )
元素代号 | X | Y | Z | P | Q |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.071 |
主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -1 |
- A、 元素X的单质可在干冰中燃烧
- B、 非金属性:P>Q
- C、 最高价氧化物的水化物的碱性:X<Z
- D、 元素X、Y、Q的简单离子半径:X>Y>Q
试题详情
蒽的某种衍生物(结构如图)是荧光分子,分子中含有冠醚结构,可用作由光引发的分子开关。下列说法正确的是( )

15-冠-5冠醚空腔直径/pm | 离子直径/pm |
170~220 | Li+:152 |
Na+:204 | |
K+:276 |
- A、 冠醚结构中5个O原子与Na+不可能在同一平面上
- B、 15-冠-5空穴也能适配Li+、K+
- C、 分子识别是超分子的唯一特征
- D、 一个该荧光分子中Na+周围的配位键数目为6
试题详情
我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时可发生反应:2KNO3+S+3C K2S+N2↑+3CO2↑,生成物K2S的晶胞结构如图。下列有关说法不正确的是( )
K2S+N2↑+3CO2↑,生成物K2S的晶胞结构如图。下列有关说法不正确的是( )
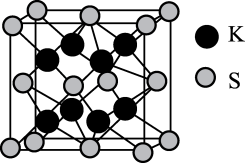
- A、 S和C均有多种同素异形体
- B、 N2中含有的σ键和π键数目之比为1∶2
- C、 K2S晶胞无隙并置后的晶体具有各向异性
- D、 K2S晶体中,每个S2-周围紧邻4个K+
试题详情
离子液体是在室温或接近室温时呈液态的盐类物质。1-乙基-3-甲基咪唑四氟硼酸盐离子液体的结构如图所示,下列相关叙述不正确的是( )
![]()
- A、 所有原子均满足8电子稳定结构
- B、 该离子液体属于离子化合物
- C、 BF
的空间结构为正四面体
- D、 离子晶体中引入有机基团有利于降低离子化合物的熔点
非选择题
试题详情
C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
试题详情
某种食品添加剂由四种元素组成(结构如图),已知X、Y、Z、W为短周期主族元素,且原子序数依次增大,X与Z同主族,W与X原子的最外层电子数之和等于Y原子的最外层电子数,Y是地壳中含量最多的元素。

请回答下列问题:
试题详情
如表是元素周期表的一部分,其中的数字编号代表对应的元素。

试题详情
超分子化学在识别、催化、传输等功能方面已迅速渗透到各学科领域。如图是一种由两个相同分子(a)组装形成的分子盒(b)。请回答:

试题详情
Cu可形成多种配合物,一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂等。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组制备[Cu(NH3)4]SO4·H2O晶体并测定其纯度。根据下列信息回答问题:
试题详情
通过X射线衍射实验,结合计算可以获得晶体结构的多方面信息,请计算:





