选择题
试题详情
下列图示与对应的叙述不相符合的是( ) 
- A、 图甲表示燃料燃烧反应的能量变化
- B、 图乙表示酶催化反应的反应速率随反应温度的变化
- C、 图丙表示弱电解质在水中建立电离平衡的过程
- D、 图丁表示强碱滴定强酸的滴定曲线
试题详情
理论研究表明,在101kPa和298K下,  异构化反应过程的能量变化如图所示。下列说法错误的是( )
异构化反应过程的能量变化如图所示。下列说法错误的是( )

- A、 HCN比HNC稳定
- B、 该异构化反应的
- C、 正反应的活化能大于逆反应的活化能
- D、 使用催化剂,可以改变反应的反应热
试题详情
某反应由两步反应 构成,其反应能量变化曲线如图所示,下列叙述正确的是( )
构成,其反应能量变化曲线如图所示,下列叙述正确的是( )

- A、 两步反应均为吸热反应
- B、
的反应一定需要加热
- C、 A与C的能量差为
, 发生
反应时,会向环境释放能量
- D、 三种物质中C最不稳定
试题详情
科学家利用过渡金属氮化物(TMNS)在常温下催化实现氨的合成,其反应机理如图所示。下列说法正确的是( )

- A、 TMNS大大降低了合成氨反应的活化能,提高了合成氨的转化率
- B、 TMNS表面N2分子被氧化为氨分子
- C、 TMNS表面上氨脱附产生的空位有利于吸附N2
- D、 高温有利于提高TMNS催化氨的合成效率
试题详情
我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如下,下列说法正确的是( )

- A、 由X、Y生成M的总反应原子利用率为100%
- B、 ①→②过程属于吸热反应
- C、 X、Y、M分别为甲烷、二氧化碳和乙醇
- D、 反应过程中有C-H键、C-C键、O-H键生成
试题详情
将溶质物质的量相同的酸溶液与碱溶液相混合,a:盐酸和氢氧化钠,b:醋酸和氢氧化钠,c:醋酸和氨水。其所放出热量比较,正确的是( )
- A、 a>b>c
- B、 c>b>a
- C、 b>c>a
- D、 a=b=c
试题详情
Cu-Ce-Ox固溶体作为金属催化剂,能有效促进电化学还原,反应产生CH4和C2H4的共同中间体,•CO在催化剂表面的反应机理如图所示。下列说法错误的是( )
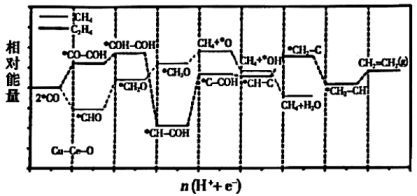
- A、 Cu-Ce-Ox固溶体催化剂对生成CH4有较高选择性
- B、 制约CO2还原为C2H4反应速率的是•CH-COH→•C-COH
- C、 由•CO生成•OH的反应为•CO+5H++5e-=CH4+•OH
- D、 •CH3O→CH4+•O只有化学键的形成
试题详情
在25℃、 下,
下, 氢气燃烧生成气态水的能量变化如下图所示,已知:2H2(g) + O2(g)→2H2O(g)
氢气燃烧生成气态水的能量变化如下图所示,已知:2H2(g) + O2(g)→2H2O(g)  , 下列有关说法正确的是( )
, 下列有关说法正确的是( )

- A、 O-H键的键能为930kJ·mol-1
- B、 a= 249
- C、 物质所具有的总能量大小关系为:甲>乙>丙
- D、 1molH2O(l)分解为2molH与1molO时吸收930kJ热量
试题详情
最近科学家采用真空封管法制备的磷化硼纳米颗粒,作 与
与 合成
合成 [
[
 ]反应的催化剂,在发展非金属催化剂实现
]反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。

下列说法正确的是( )
- A、
与
生成
和
的反应为放热反应
- B、 上述反应生成的副产物中,
比
多(相同条件下)
- C、 在合成甲醇的过程中,降低
能量变化,可提高反应速率
- D、 反应过程中有极性键和非极性键的断裂和生成
试题详情
研究表明I-可以作为水溶液中SO2歧化反应的催化剂,3SO2(g)+2H2O(l)→2H2SO4(aq)+S(s),该过程一般通过如下步骤来实现:
①SO2(g)+4I-(aq)+4H+(aq)→S(s)+2I2(g)+2H2O(l)+Q1(Q1<0)
②I2(g)+2H2O(l)+SO2(g)→SO(aq)+4H+(aq)+2I-(aq)+Q2(Q2>0)
上述反应过程中能量变化不可能是下列示意图中的( )
- A、

- B、

- C、

- D、

试题详情
近日,我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法错误的是( )

- A、 使用催化剂能有效减少副产物CO的生成;使用s-SnLi催化剂,中间产物更不稳定
- B、 充电时,阳极电极周围pH降低
- C、 放电时,每生成1 mol HCOO- , 转移1 mol电子
- D、 放电时,负极电极反应式为Zn+4OH--2e-=
试题详情  单原子催化剂具有良好的电催化性能,催化转化
单原子催化剂具有良好的电催化性能,催化转化  的历程如下。
的历程如下。

下列说法错误的是( )
- A、
催化转化的产物是
和
- B、 过程②→③涉及化学键的断裂与生成
- C、 反应过程中,C的杂化方式未发生改变
- D、 生成
,需要
电子
试题详情
氢气是一种清洁能源,下图是  和
和  反应生成
反应生成  的能量变化示意图,由图可知( )
的能量变化示意图,由图可知( )

- A、
- B、 生成
需要吸收
的能量
- C、
和
具有的总能量比
所具有的总能量高
- D、
,断键吸收的能量小于成键释放的能量
试题详情
以Pd纳米粒子为核、空心多孔碳球为壳的封装型催化剂将H2和O2直接合成  的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( )
的机理如图(a)所示。电催化还原O2时的两种可能转化路径如图(b)所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( )

- A、 直接合成法中,步骤②吸收能量,步骤④释放能量
- B、 电催化还原法制备H2O2的优点之一是避免了H2和O2共存的易爆环境
- C、 电催化还原时,2e-路径的步骤少,反应速率快
- D、 若催化剂表面对*OOH吸附过强,则易生成O* , 导致
的产率降低
试题详情
下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。
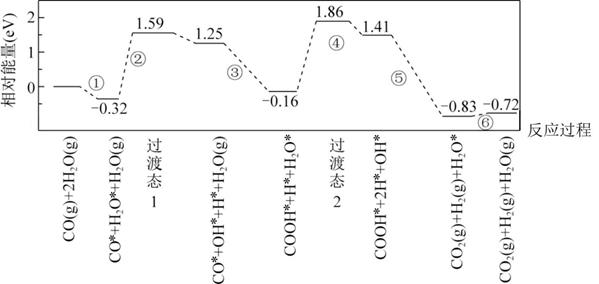
下列说法正确的是( )
- A、 ①表示CO和H2O从催化剂表面脱离的过程
- B、 ②和④中化学键变化相同,因此吸收的能量相同
- C、 由图可知CO(g)+H2O(g)=CO2(g)+H2(g)为吸热反应
- D、 本历程中的催化剂通过改变水煤气变化反应的焓变,来实现改变其反应速率
试题详情
CO与N2O在铁催化剂表面进行如下两步反应:
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
其相对能量与反应历程如下图所示,下列说法错误的是( )
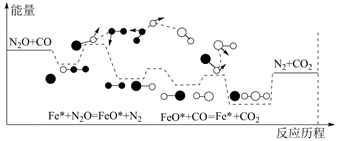
- A、 总反应是放热反应,化学方程式为CO+N2O
CO2+N2
- B、 在反应过程中,有极性键和非极性键的断裂和生成
- C、 总反应的反应速率由第一步反应决定
- D、 Fe*为反应的催化剂,FeO*为中间产物
多选题
试题详情
1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子(  );第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是( )
);第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是( )

试题详情
下列判断正确的是( )

试题详情
初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1 , 测得反应的相关数据如下:
2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1 , 测得反应的相关数据如下:
| 容 器 | 容器类型 | 初始 体积 | 初始压 强/Pa | 反应物投入量/mol | 平衡时Cl2的 物质的量/mol | |||
| HCl | O2 | Cl2 | H2O | |||||
| Ⅰ | 恒温恒容 | 1 L | 2×105 | 4 | 1 | 0 | 0 | 1 |
| Ⅱ | 绝热恒容 | 1 L | p2 | 0 | 0 | 2 | 2 | a |
| Ⅲ | 恒温恒压 | 2 L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
试题详情
利用含碳化合物合成燃料是解决能源危机的重要方法,已知煤液化过程中有反应 CO(g)+2H2(g) =CH3OH(g),其反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
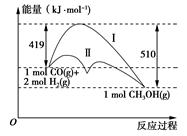
试题详情
下列说法正确的是( )
试题详情
利用新型催化剂 在太阳光的作用下将
在太阳光的作用下将 进行分解,反应过程如图所示。下列有关说法正确的是( )
进行分解,反应过程如图所示。下列有关说法正确的是( )

试题详情
N2与O2生成NO是自然界固氮的重要方式之一,下图显示了该反应中的能量变化。
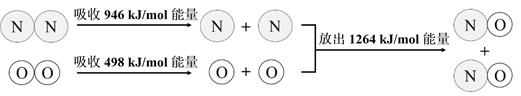
下列说法正确的是( )
试题详情
常温下,1mol化学键形成(或断裂)的能量变化用E表示。下列说法正确的是
化学键 | H—H | Cl—Cl | H—Cl |
436 | 243 | 431 |
非选择题
试题详情
对烟道气中的  进行回收再利用具有较高的社会价值。
进行回收再利用具有较高的社会价值。
试题详情
采用光电催化法或化学吸收法处理含硫化氢的废液废气,既可防止环境污染又可回收硫资源等。回答下列问题:
试题详情
氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
试题详情
一定条件下  能氧化
能氧化  制
制  ,这对资源综合利用有重要意义。相关的化学反应如下:
,这对资源综合利用有重要意义。相关的化学反应如下:
I.
II.
试题详情
甲醇是有机化工中重要的合成原料,在催化剂的作用下利用甲醇合成乙烯和丙烯的技术被称为  技术。该技术涉及的主要反应为:
技术。该技术涉及的主要反应为:
i.
ii.
请回答下列问题:
试题详情
二氧化碳的捕集与资源化利用是实现碳减排的重要途径。
试题详情
CH4-CO2重整反应[CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol]在大力推进生态文明建设、“碳达峰”、“碳中和”的时代背景下,受到更为广泛的关注。
试题详情
铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
试题详情
SO2在生产、生活中有着广泛的用途。
试题详情
氮氧化物是大气的主要污染物之一,能形成酸雨、雾霾。大气中的氮氧化物主要来源于燃料的燃烧。



