选择题
- A、 催化剂能使不起反应的物质发生反应
- B、 在化学反应前后催化剂性质和质量都不改变
- C、 催化剂能改变化学反应速率
- D、 在化学反应过程中,催化剂能提高转化率
- A、 催化转化器中的铂催化剂可加快CO的氧化
- B、 铂表面做成蜂窝状更有利于提高催化效果
- C、 在铂催化下,NO NO2可被CO还原成N2
- D、 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O
对于可逆反应mA(g)+nB(g)⇌pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v﹣t图象.下列判断正确的是( )
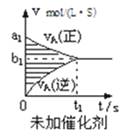

- A、 b1>b2 , t1>t2
- B、 两图中阴影部分面积一定相等
- C、 A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率
- D、 若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
- A、

- B、

- C、

- D、

- A、 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
- B、 增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
- C、 对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子增多,反应速率加快
- D、 活化分子之间的碰撞一定是有效碰撞
- A、 增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增加
- B、 有气体参加的化学反应,若缩小反应容器的体积,主要增大了活化分子的百分数
- C、 升高温度,主要增加了反应物分子中活化分子数
- D、 加入催化剂后,活化分子数增大,活化分子百分数也增大
- A、 有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而使反应速率增大
- B、 催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率
- C、 增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
- D、 升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数
- A、

- B、

- C、

- D、

- A、 反应将O3转变为O2
- B、 Cl原子是总反应的催化剂
- C、 氟氯甲烷是总反应的催化剂
- D、 Cl原子反复起分解O3的作用
- A、 电解水制氢气时,加入少量的Na2SO4
- B、 利用H2O2水溶液制氧气时,加入少量的MnO2固体
- C、 实验室用浓盐酸制氯气时,需加入MnO2固体
- D、 纯锌与硫酸反应制氢气时,滴入少量硫酸铜
- A、 参加反应的物质的性质是决定化学反应速率的重要因素
- B、 反应物分子(或离子)间的每次碰撞是反应的先决条件
- C、 应物的分子的每次碰撞都能发生化学反应
- D、 活化分子具有比普通分子更高的能量
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③活化分子比普通分子具有较高的能量
④化学反应的实质是原子的重新组合
⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程
⑥化学反应的实质是活化分子有合适取向时的有效碰撞.
- A、 ①③④⑤
- B、 ②③⑥
- C、 ③④⑤⑥
- D、 ②④⑤
①NO(g)+Br2(g)═NOBr2(g)(慢);
②NO(g)+NOBr2(g)═2NOBr(g)(快)
下列有关该反应的说法正确的是( )
- A、 反应速率主要取决于②的快慢
- B、 NOBr2是该反应的催化剂
- C、 该反应的焓变等于akJ•mol﹣1
- D、 反应速率:v(NO)=v(NOBr)=2v(Br2)
工业制硫酸中一步重要的反应是:SO2在400~500℃的条件下进行催化氧化:2SO2+O2 2SO3 , 其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
2SO3 , 其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
- A、 使用催化剂是为了加快反应速率,提高生产效率
- B、 在上述条件下,反应达平衡时容器中存在SO2、O2、SO3三种物质
- C、 生产中一定要不断提供热量,使温度达到400~500℃
- D、 达到平衡时,SO2的浓度与SO3的浓度可能相等
非选择题
2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3放出的热量99kJ.请回答下列问题:

为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:


定性分析:
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞.


【实验用品】
试剂:0.1mol•L﹣1 H2C2O4溶液、0.1mol•L﹣1 KMnO4溶液、稀硫酸、MnSO4固体
仪器:试管(若干个)、胶头滴管(2支)
【实验内容】
在1号和2号试管中分别加入10mL H2C2O4溶液和少量稀硫酸,在1号试管中加入硫酸锰固体.然后在两支试管中加入0.1mol•L﹣1 KMnO4溶液.现做如下对比实验,现象如下表所示:
加入药品 | 不加MnSO4的稀硫酸酸化的 H2C2O4溶液 | 加少量MnSO4的稀硫酸酸化的 H2C2O4溶液 |
实验现象(褪色时间) | 溶液褪色很慢(31秒) | 溶液褪色很快(4秒) |
请回答下列问题.






